
分析 在标准状况下,蒸气密度为4.02g/L,则有机物的相对分子质量为22.4×4.02=90,生成的气体依次通过浓硫酸和碱石灰,经测定,前者增重5.4g,后者增重13.2g,可知n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,则N(C)=$\frac{0.3}{0.1}$=3,N(H)=$\frac{0.3}{0.1}$×2=6,结合相对分子质量确定O原子个数可确定有机物分子式,该有机物核磁共振氢谱图有4组峰,峰面积比为3:1:1:1,可确定有机物结构简式,以此解答该题.
解答 解:(1)在标准状况下,蒸气密度为4.02g/L,则有机物的相对分子质量为22.4×4.02=90,生成的气体依次通过浓硫酸和碱石灰,经测定,前者增重5.4g,后者增重13.2g,可知n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,则N(C)=$\frac{0.3}{0.1}$=3,N(H)=$\frac{0.3}{0.1}$×2=6,则有机物中含有的O原子个数为$\frac{90-3×12-6}{16}$=3,则有机物分子式为C3H6O3,
答:该有机物的分子式为C3H6O3;
(2)该有机物核磁共振氢谱图有4组峰,峰面积比为3:1:1:1,有机物结构简式为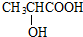 ,
,
答:有机物结构简式为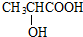 ;
;
(3)在浓硫酸的作用下,A可以通过缩聚反应生成高分子化合物,方程式为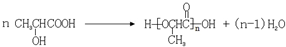 ,
,
答:反应方程式为 .
.
点评 本题考查有机物的推断,为高频考点,侧重考查学生的分析能力、计算能力,关键是计算确定A的分子式,熟练掌握官能团的性质与转化,理解结构和性质的关系,难度中等.


科目:高中化学 来源: 题型:解答题
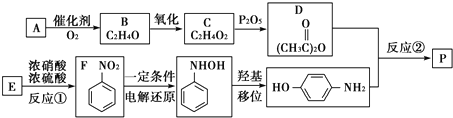
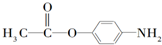
 -NH2中-NH2上的氢原子较活泼.
-NH2中-NH2上的氢原子较活泼. .
.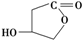 ,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号).
,W的酸性水解产物的名称为3,4-二羟基丁酸;W不具有的化学性质中是C(填代号). 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
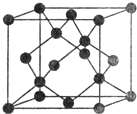 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
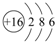
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
 .
.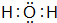 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.NaCl固体可导电
B.NaHSO4溶于水电离出H+,则NaHSO4属于酸
C.HCl溶于水能导电,但 液态HCl不能导电
液态HCl不能导电
D.导电能力强的溶液里能够自由移动的离子数目一定比导电能力弱的溶液里能够自由移动的离子数目多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )
A.5mol·L-1 B.3.25mol·L-1 C.7mol·L-1 D.6.25mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com