
元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。若发现119号元素,请您在元素大厦中安排好它的“房间”
A.第七周期第0族 B.第六周期ⅡA族
C.第八周期第ⅠA族 D.第七周期第ⅦA族
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:实验题
为验证MnO2在KC1O3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:

(1)连接好装置后,如何检查装置的气密性? 。
(2)取2.45 g KClO3固体粉末与0.87g MnO2粉末充分混匀,置于如图所示装置的试管中,充分加热后,停止加热,移去酒精灯之前,应先 ;调节量筒内液面与水槽内液面高度相同,量筒内收集到的气体体积 0.735L(填“>” “<”或“=”)。已知室温下气体摩尔体积为24.5 L•mol-1,不考虑氧气在水中的溶解及水蒸气的影响)。
(3)取充分加热后试管中的残余固体,溶于50 mL 1.0 mol • L-1稀硫酸中,加入50 mL 0.30 mol • L-1 Na2C2O4 溶液,待与Mn02作用完毕后,用 0.10 mol • L-1 KMn04标准溶液进行滴定,消耗KMn04标准溶液V mL(已知Mn2+对滴定反应有催化作用)[
A.写出Mn02与Na2C204反应的离子方程式 ;
B.当消耗KMnO4标准溶液的体积V= mL时,表明MnO2在反应前后质量不变。
C.若盛装标准液的滴定管没有用标准液润洗,所测Mn02质量会 (填“偏大”、“偏小”或“不变”,下同);若滴定终点时明显出现黑色沉淀,所测质量会 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
下列反应中属于加成反应的是
A乙烯使酸性KMnO4溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色
D.甲烷与氯气混合,黄绿色消失
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化时一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
下列说法合理的是
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.能形成+7价含氧酸及其盐的元素一定属于主族元素
D.原子最外层电子数等于6的元素一定属于主族元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:填空题
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
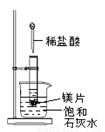
(1)实验中观察到的现象是____________________;
(2)产生上述现象的原因是____________________;
(3)写出有关的离子方程式:________________ __。
(4)由实验推知,反应中生成MgCl2和H2形成化学键时
所释放的总能量____(填“大于”“小于”或“等于”)消耗镁片和盐酸时断裂化学键所吸收的总能量。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
形成原电池的条件一般有:①电解质溶液;②两个电极;③能自发地发生氧化还原反应;④形成闭合回路,请根据上述条件判断下列装置中属于原电池的是( )
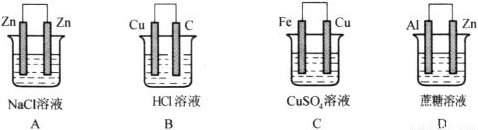
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
雷雨天闪电时空气中有臭氧生成,下列说法正确的是( )
A.16O2和18O3互为同位素
B.O2和O3的相互转化是物理变化
C.等物质的量的O2和O3含有相同的质子数
D.等质量的O2和O3含有相同的O原子数
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
I.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是________,N2F2分子中N原子的杂化方式是____________,1mol N2F2含有______个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N—Si—N________Si—N—Si(填“>”“<”或“=”),原因是_________。
II.金属元素在现代工业中也占据极其重要的地位,钛被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大特点,是理想化工设备材料。
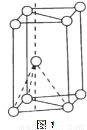
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图1所示,为_______
堆积(填堆积方式)。
4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是_______。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________。

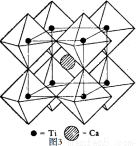
(5)钙钛矿晶体的结构如图3所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com