
·ÖĪö £Ø1£©ŅŃÖŖ¢Ł2CO£Øg£©+O2£Øg£©=2CO2£Øg£©”÷H1=-566kJ•mol-1
¢Ś£Øl£©+O2£Øg£©=SO2£Øg£©”÷H2=-296kJ•mol-1
·“Ó¦2CO£Øg£©+SO2£Øg£© $\frac{\underline{“߻ƼĮ}}{”÷}$2CO2£Øg£©+S£Øl£©æÉŅŌŹĒ¢Ł-¢ŚµĆµ½·“Ó¦ģŹ±ä£»
£Ø2£©Ę½ŗā³£ŹżµČÓŚÉś³ÉĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż³żŅŌ·“Ó¦ĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż£¬
øĆ·“Ó¦ŹĒŅ»øö·“Ó¦Ē°ŗóĘųĢåĢå»ż¼õŠ””¢·ÅČȵÄæÉÄę·“Ó¦£¬
A£®ŌŚ·“Ó¦“ļµ½Ę½ŗāÖ®Ē°£¬ČŻĘ÷ÄŚĘųĢåµÄŃ¹ĒæŌŚ²»¶Ļ¼õŠ”£»
B£®Įņµ„ÖŹĪŖ¹ĢĢ壬·ÖĄė³öĮņ¶Ō·“Ó¦ĖŁĀŹĪŽÓ°Ļģ£»
C£®µ±n£Ø£ØCO£©£ŗn£ØSO2£©£ŗn£ØCO2£©=2£ŗ1£ŗ2Ź±£¬·ūŗĻ·“Ó¦±Čµ«·“Ó¦²»Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£»
D£®Ź¹ÓĆ“ß»Æ¼ĮÖ»øıä»Æѧ·“Ó¦ĖŁĀŹµ«²»Ó°ĻģĘ½ŗāµÄŅĘ¶Æ£¬×¢ŅāĘ½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ÓėĪļÖŹµÄÅضČĪŽ¹Ų£»
£Ø3£©A£®Ń”ÓĆøüÓŠŠ§µÄ“߻ƼĮ²»Ó°ĻģĘ½ŗāŅĘ¶Æ£»
B£®Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬Éżøß·“Ó¦ĢåĻµµÄĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£»
C£®Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬½µµĶ·“Ó¦ĢåĻµµÄĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£»
D£®ĖõŠ”ČŻĘ÷µÄĢå»ż£¬Ōö“óŃ¹Ē棻
£Ø4£©½«1mol SO2ĘųĢåĶØČė1 L2mol/LµÄNaOHČÜŅŗÖŠ·¢Éś·“Ó¦SO2+2NaOH=Na2SO3+H2O£¬ČÜŅŗÖŠŃĒĮņĖįøłĄė×ÓĖ®½āČÜŅŗĻŌ¼īŠŌ£»
£Ø5£©COŅ»æÕĘųČ¼ĮĻµē³ŲÖŠŹ¹ÓƵĵē½āÖŹŹĒ²ōŌÓY2O3µÄZrO2¾§Ģ壬ĖüŌŚøßĪĀĻĀÄÜ“«µ¼O2-£¬øŗ¼«ŹĒŅ»Ńõ»ÆĢ¼Ź§µē×ÓÉś³É¶žŃõ»ÆĢ¼£¬“«µ½Ąė×ÓĪŖO2-£¬ŅĄ¾ŻµēŗÉŹŲŗćŹéŠ“£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖŅ»Ńõ»ÆĢ¼ŗĶŃõĘų·“Ӧɜ³É¶žŃõ»ÆĢ¼£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ¢Ł2CO£Øg£©+O2£Øg£©=2CO2£Øg£©”÷H1=-566kJ•mol-1
¢Ś£Øl£©+O2£Øg£©=SO2£Øg£©”÷H2=-296kJ•mol-1
·“Ó¦2CO£Øg£©+SO2£Øg£© $\frac{\underline{“߻ƼĮ}}{”÷}$2CO2£Øg£©+S£Øl£©æÉŅŌŹĒ¢Ł-¢ŚĖłµĆ£¬ĖłŅŌøĆ·“Ó¦µÄģŹ±ä”÷H=-566kJ•mol-1-£Ø-296kJ•mol-1£©=-270kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ-270kJ/mol£»
£Ø2£©2CO£Øg£©+SO2£Øg£© $\frac{\underline{\;“߻ƼĮ\;}}{”÷}$ 2CO2 £Øg£©Ź®S£Ø1£©Ę½ŗā³£ŹżµČÓŚÉś³ÉĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż³żŅŌ·“Ó¦ĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż£¬K=$\frac{{c}^{2}£ØC{O}_{2}£©}{{c}^{2}£ØCO£©c£ØS{O}_{2}£©}$£¬
A£®ŌŚ·“Ó¦“ļµ½Ę½ŗāÖ®Ē°£¬ČŻĘ÷ÄŚĘųĢåµÄŃ¹ĒæŌŚ²»¶Ļ¼õŠ”£»
B£®Įņµ„ÖŹĪŖ¹ĢĢ壬·ÖĄė³öĮņ¶Ō·“Ó¦ĖŁĀŹĪŽÓ°Ļģ£»
C£®µ±n£Ø£ØCO£©£ŗn£ØSO2£©£ŗn£ØCO2£©=2£ŗ1£ŗ2Ź±£¬·ūŗĻ·“Ó¦±Čµ«·“Ó¦²»Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£»
D£®Ź¹ÓĆ“ß»Æ¼ĮÖ»øıä»Æѧ·“Ó¦ĖŁĀŹµ«²»Ó°ĻģĘ½ŗāµÄŅĘ¶Æ£¬×¢ŅāĘ½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ÓėĪļÖŹµÄÅضČĪŽ¹Ų£»
¹Ź“š°øĪŖ£ŗ$\frac{{c}^{2}£ØC{O}_{2}£©}{{c}^{2}£ØCO£©c£ØS{O}_{2}£©}$£»AD£»
£Ø3£©A£®Ń”ÓĆøüÓŠŠ§µÄ“߻ƼĮ²»Ó°ĻģĘ½ŗāŅĘ¶Æ£¬²»ÄÜĢįøßSO2×Ŗ»ÆĀŹ£¬¹ŹA“ķĪó£»
B£®Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬Éżøß·“Ó¦ĢåĻµµÄĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬¶žŃõ»ÆĮņ×Ŗ»ÆĀŹ¼õŠ”£¬¹ŹB“ķĪó£»
C£®Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬½µµĶ·“Ó¦ĢåĻµµÄĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¶žŃõ»ÆĮņ×Ŗ»ÆĀŹŌö“󣬹ŹCÕżČ·£»
D£®ĖõŠ”ČŻĘ÷µÄĢå»ż£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¶žŃõ»ÆĮņ×Ŗ»ÆĀŹŌö“󣬹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗCD£»
£Ø4£©½«1mol SO2ĘųĢåĶØČė1 L2mol/LµÄNaOHČÜŅŗÖŠ·¢Éś·“Ó¦SO2+2NaOH=Na2SO3+H2O£¬ČÜŅŗÖŠŃĒĮņĖįøłĄė×Ó·Ö²½Ė®½āČÜŅŗĻŌ¼īŠŌ£¬SO32-+H2O?HSO3-+OH-£¬HSO3-+H2O?H2SO3+OH-£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗc£ØNa+£©£¾£ØSO32-£©£¾c£ØOH-£©£¾c£ØHSO3-£©£¾c £ØH+£©£¬
¹Ź“š°øĪŖ£ŗc£ØNa+£©£¾£ØSO32-£©£¾c£ØOH-£©£¾c£ØHSO3-£©£¾c £ØH+£©£»
£Ø5£©Ī²ĘųÖŠµÄCOæÉŅŌÖĘ³ÉCOŅ»æÕĘųČ¼ĮĻµē³Ų£®COŅ»æÕĘųČ¼ĮĻµē³ŲÖŠŹ¹ÓƵĵē½āÖŹŹĒ²ōŌÓY2O3µÄZrO2¾§Ģ壬ĖüŌŚøßĪĀĻĀÄÜ“«µ¼O2-£®øŗ¼«µē¼«·“Ó¦ĪŖ£ŗCO-2e-+O2-=CO2£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2CO+O2=2CO2£¬
¹Ź“š°øĪŖ£ŗCO-2e-+O2-=CO2£»2CO+O2=2CO£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗā¼ĘĖć”¢»ÆŃ§Ę½ŗāÓ°ĻģŅņĖŲ”¢Ģ½¾æ»Æѧ·“Ó¦ĖŁĀŹÓ°ĻģŅņĖŲ”¢µē½āÖŹČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”±Č½ĻµČ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
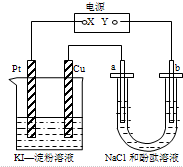
| A£® | XæÉŅŌŹĒµēŌ“µÄøŗ¼«£¬Ņ²æÉŅŌŹĒµēŌ“µÄÕż¼« | |
| B£® | ¼××°ÖƵĵē³Ų·“Ó¦ŹĒ£ŗ2Cu2++4I-=2CuI”ż+I2 | |
| C£® | ŅŅ×°ÖĆaµē¼«ÖÜĪ§ČÜŅŗ±äŗģÉ«£¬pH±ä“ó | |
| D£® | ŅŅ×°ÖĆÖŠNa+Ļņbµē¼«ĒØŅĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŌŖĖŲÖÜĘŚ±ķŹĒѧĻ°»ÆѧµÄÖŲŅŖ¹¤¾ß£¬ÓŅĶ¼ŹĒŌŖĖŲÖÜĘŚ±ķÖŠµÄŅ»øń£¬ŅŌĻĀ»ńČ”µÄŠÅĻ¢“ķĪóµÄŹĒ£Ø””””£©
ŌŖĖŲÖÜĘŚ±ķŹĒѧĻ°»ÆѧµÄÖŲŅŖ¹¤¾ß£¬ÓŅĶ¼ŹĒŌŖĖŲÖÜĘŚ±ķÖŠµÄŅ»øń£¬ŅŌĻĀ»ńČ”µÄŠÅĻ¢“ķĪóµÄŹĒ£Ø””””£©| A£® | øĆŌŖĖŲµÄŌ×ÓŠņŹżŹĒ53 | B£® | øĆŌŖĖŲŹōÓŚ½šŹōŌŖĖŲ | ||
| C£® | øĆŌŖĖŲµÄŌ×ÓŗĖĶāÓŠ53øöµē×Ó | D£® | øĆŌŖĖŲµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ126.9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na+ H+ SO42- | B£® | H+ Ag+ NO3- | C£® | K+ HCO3-Cl- | D£® | Na+ NO3- Fe2+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 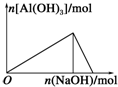 ĻņAlCl3ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ | B£® | 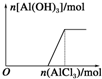 ĻņNaOHČÜŅŗÖŠµĪ¼ÓAlCl3ČÜŅŗ | ||
| C£® | 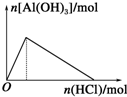 ĻņNa[Al£ØOH£©4]ČÜŅŗÖŠĶØČėCO2 | D£® |  ĻņAlCl3ČÜŅŗÖŠµĪ°±Ė® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  Mg2+ Mg2+ | B£® |  Cl Cl | C£® |  Ar Ar | D£® | K  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬0.05NAøöäå·Ö×ÓµÄCCl4ČÜŅŗæÉŅŌŗĶ1.12LŅŅĻ©Ē”ŗĆĶźČ«·“Ó¦ | |
| B£® | ±ź×¼×“æöĻĀ£¬11.2LµÄĀČĘų·Ö×Ó²Ī¼ÓŃõ»Æ»¹Ō·“Ó¦£¬×ŖŅʵĵē×ÓŹżÄæ²»Ņ»¶ØŹĒNAøö | |
| C£® | ½«·Ö×Ó×ÜŹżĪŖNAµÄNH3ŗĶHClµÄ»ģŗĻĘųĢåÖĆÓŚ±ź×¼×“æöĻĀ£¬ĘäĢå»ż“óŌ¼ĪŖ22.4L | |
| D£® | 16gCH4Óė19gH3O+Ėłŗ¬ÓŠµÄÖŹ×ÓŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
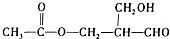 Ź§Č„¹āѧ»īŠŌµÄŹĒ£Ø””””£©
Ź§Č„¹āѧ»īŠŌµÄŹĒ£Ø””””£©| A£® | H2 | B£® | CH3COOH | C£® | Cu/O2 | D£® | Ag£ØNH3£©2OH |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com