
����Ŀ��ijʵ��С������ͼװ���Ʊ���������Һ����̽�������ʡ�
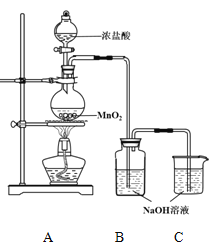
��1��д��װ��Ũ������������� ��A����ƿ�ڽ��еķ�Ӧ��Ũ�������ֳ��Ļ�ѧ������ ��
��2��д��װ��B�з��������з�Ӧ��ѧ����ʽ ��
��3��װ��c�������� ����Ӧֹͣ����ȡϴ��ƿ����ɫ��Һ5mL�ֱ�����������ʵ�飺
���� | ���� |
A������ҺpH, �������еμ�2����̪ | pH = 13, ��Һ��죬5min����ɫ |
B�� ��������μ������� | ��Һ��ɻ���ɫ |
��4���������ϣ���̪�ı�ɫ��ΧΪ8.2��10���ҷ�̪��ǿ������Һ�к�ɫ����ȥ��Ϊ̽������A����Һ��ɫ��ԭ��������������ʵ����
���� | ���� |
ȡ NaOH��Һ�������еμ�2�η�̪ | ��Һ��죬30min����ɫ |
��ý��ۣ���ʵ��С���Ʊ�������Һ����Ư���ԡ�
��5������B����Һ���ɻ���ɫ��ԭ���� (�����ӷ���ʽ��ʾ)��
��������1����Һ©�������Ժͻ�ԭ��
��2��Cl2+2NaOH��NaCl+NaClO+H2O HCl+NaOH��NaCl+H2O
��3�����ն���������������Ⱦ���� ��4��5ml��pH��13��5��2H+ + ClO- + Cl-��Cl2��+ H2O
��������
�����������1���������������֪װ��Ũ�����������������Һ©��������Ͷ��������ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����A����ƿ�ڽ��еķ�Ӧ��Ũ�������ֳ��Ļ�ѧ���������Ժͻ�ԭ�ԡ�
��2����װ��B���������������Ʒ�Ӧ���ɴ����������Ȼ��ƺ�ˮ���Ӷ��Ƶ�����Һ����Ӧ�ķ���ʽΪCl2+2NaOH��NaCl+NaClO+H2O���������ɵ������л����лӷ������Ȼ��⣬�Ȼ������������Ʒ����кͷ�Ӧ������ʽΪCl2+2NaOH��NaCl+NaClO+H2O��
��3�������ж�����װ��C�����������ն���������������Ⱦ������
��4����̪��ǿ������Һ�к�ɫ����ȥ����ͬ�������ͬpHֵ������������Һ���μ�2�η�̪��Һ��죬30min����ɫ��������Һ��pH=13����Һ��죬5min����ɫ����ɫʱ��̣�˵����ʵ��С���Ʊ�������Һ����Ư���ԣ�
��3���������������Ϊ+1�ۣ�������Ϊ-1�ۣ������������·������з�Ӧ��������������Ӧ�ķ���ʽΪ2H++ClO-+Cl-��Cl2��+H2O��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���G��һ��ҽҩ�м��壬��ͨ����ͼ��ʾ·�ߺϳɡ�A��ʯ�ͻ�������Ҫ��Ʒ�ҷ���������ԭ����ͬһƽ���ϣ�H�ķ���ʽ��C7H8��

��֪��![]()
��ش��������⣺
��1��A�Ľṹ��ʽ��________��
��2��H��I�Ļ�ѧ��Ӧ����ʽΪ_______ ��
B��������Һ��Ӧ�Ļ�ѧ����ʽ��________________________________��
��3��C��D�ķ�Ӧ������________��I��J�ķ�Ӧ������________��
��4������E������һ�������·������Ӽ���ˮ����һ�ֻ�״���Ľṹ��ʽ��______________________��
��5����������������F��ͬ���칹��(��F)����________(������)�֡�
�������Ȼ�����Һ������ɫ��Ӧ
�ں�����ȷ�������������![]() �ṹ
�ṹ
�۱�����������ȡ����
��������̼��������Һ��Ӧ�Һ˴Ź������ײⶨ��5�����շ��ͬ���칹��Ľṹ��ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�0.04��������������ˮ���Ƴ�100 mL��Һ���ʵ���Ũ��Ϊ____mol/L�� pHΪ______��Ҫʹ����pH��Ϊ11��(������Һ����������ϡ��ǰ��Һ�����֮��)����������ˮ��Ӧ��________mL��������pHΪ10��NaOH��Һ��Ӧ��______mL��������0.01 mol��L��1�����ᣬӦ��________mL(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
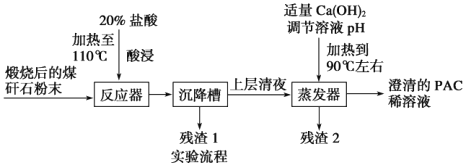
����Ŀ��ij��ѧʵ���Ҷ�ú��ʯ(��Ҫ��Al2O3��SiO2��Fe2O3)�Ʊ��ۺ��Ȼ���{[Al2(OH)nCl6��n]m(1��n��5��m��10)�����PAC����һ�����͡���Ч���������;�ˮ��}���乤���������£�
��ش��������⣺
��1����Ũ��������20%����������IJ���������______________________________��
��2����20%������������йط�Ӧ�����ӷ���ʽΪ_____________________________��
��3������2����Ҫ�ɷ��ǣ����ʵ��֤����Ľ���(�����������):_____________________��
��4���ɳ����PACϡ��Һ��þۺ��Ȼ������壬��ʵ�������_________________���õ���PAC�ֲ�Ʒ�п��ܺ��е�����������____________��
��5���Ӳ��������ʵĽǶ������ǣ�������ҺpH���Լ��ɸ�Ϊ________(����ĸ)��
A��NaOH B��Al C����ˮ D��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺������п����п����Ҫ�ɷ���ZnS��Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=��930 kJ��mol��1
H1=��930 kJ��mol��1
2C(s) + O2(g) = 2CO(g) ![]() H2=��221 kJ��mol��1
H2=��221 kJ��mol��1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ��mol��1
H3=198 kJ��mol��1
��ӦZnS(s) + C(s) + 2O2(g)��Zn(g) + CO2(g) + SO2(g)��![]() H4= kJ��mol��1��
H4= kJ��mol��1��
��2����Ӧ�����ɵ�CO2��NH3�������һ�������·�Ӧ�ϳ�������
2NH3��g��+CO2��g��![]() CO��NH2��2��s��+H2O��g����H��0
CO��NH2��2��s��+H2O��g����H��0
���÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־�� ��
a��CO2��H2O(g)Ũ����� b�������������ѹǿ���ٸı�
c��2v(NH3)�� = v(H2O)�� d�������л��������ܶȲ��ٸı�
������߰�����ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��д��������
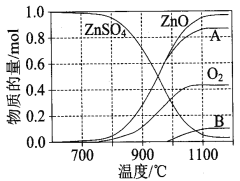
��3������п�ɹ㷺����ӡȾýȾ����ľ�ķ�������ZnSO4���ȷֽ�����и��������ʵ������¶ȱ仯��ϵ��ͼ��ʾ��
��700����980��ʱ������Ӧ���������ʶ�������ZnO����������÷�Ӧ��2L�ܱ������ڽ��У�10minʱ��������ɵ����������ʵ���Ϊ0.3mol�������ʱ������������������Ϊ ��
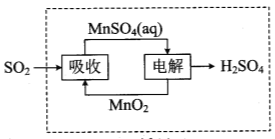
�� ����п�ֽ����ɵ�SO2����ͼ�е�ѭ���ɵõ�H2SO4��ѭ���е�����������Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���軯����NaCN������Ҫ�Ļ���ԭ�ϣ������ڻ�ѧ�ϳɡ�ұ��ҵ�ȣ��ش��������⣺
��1�����ô����̿��������Ӧ��ȡ NaCN��ͬʱ����ˮ���ɣ�д����Ӧ�Ļ�ѧ����ʽ������������ת�Ƶķ������Ŀ______________��
��2���ִ��ɽ�������NaCN��Һ����Ȼ�����н�ȡ����ĺ�����Au����ʯ���õ� Na[Au��CN��2]������Ͻ���������Һ������п��ԭ Na[Au��CN��2]���ɽ�����ȡ����Ӧ�Ļ�ԭ������______________��
��3����ͼΪ�ú�NaCN�ķ�ˮ�ϳɻ�Ѫ����K4Fe��CN��6������Ҫ����������ͼ��
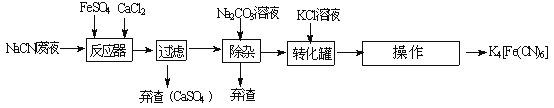
��֪��ͬ�¶����ܽ�ȣ�Na4Fe��CN��6��K4Fe��CN��6
�� ʵ������NaCN��������NaCN��Һʱ��Ӧ�Ƚ�������______________��Һ����������ˮϡ�͡�
����ת�����з�����Ӧ�Ļ�ѧ����ʽΪ______________��
������̼������Һ��ҪĿ����______________��
�ܡ����������ھ���Ϊ______________��
��4��CN -�������ˮ����Ⱦ��ijС�������·����Դ���ˮ���д�������ͼװ��ģ��绯ѧ������CN -���йؽ��������
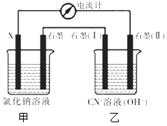
ʵ����� | �缫��X�� | NaCl��ҺŨ����mol/L�� | ����ʯī����ͨ������ | �����ƶ�����A�� |
��1�� | Fe | 0��l | ���� | I |
��2�� | Al | 0.1 | ���� | 1.5�� |
��3�� | Fe | 0.1 | 02 | 2�� |
��4�� | Al | 0.5 | ���� | 1.6�� |
�����ҳ���ʯī��I�����������������ʣ���缫��ӦʽΪ___________��
����ʵ������绯ѧ������CN -ʱ��Ӱ�촦�����ʵ�������___________��___________���δ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
��������ͼ��ʾ������˵����ȷ���ǣ� ��
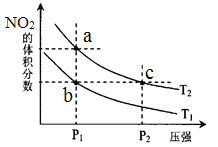
A��a��c����ķ�Ӧ���ʣ�a��c
B��a��b�����ת���ʣ�a��b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M���ӵ����ģ����ͼ��ʾ����AΪԭ�Ϻϳ�B��M��·�����£�
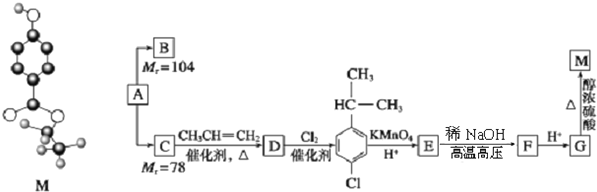
��֪��A����Է�������Ϊ26��
��1��A������Ϊ____________ ��M�ķ���ʽΪ____________��
��2����״��B�ĺ˴Ź���������ֻ��һ�ַ壬����ʹ������Ȼ�̼��Һ��ɫ����B�Ľṹ��ʽΪ____________��
��3����1molE��ȫת��ΪFʱ����Ҫ____________ molNaOH��
��4��G�еĺ��������ŵ�������____________��д����G��Ӧ���ɸ߷��ӵĻ�ѧ��Ӧ����ʽ��____________��
��5��M��ͬ���칹���ж��֣����������������ͬ���칹�干��____________����
���ܷ���������Ӧ �����б����ұ�����һ��ȡ����������
����FeCl3��Һ������ɫ
��1mol���л����������Ʒ�Ӧ����1mol����(һ��̼ԭ����ͬʱ��������-OH���ȶ�)
������һЩ���������ɵ���Ԫȩ��д������һ�ֵĽṹ��ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭ˿��Ũ���ᷴӦ����֤��������ʵ�ʵ��װ�á�
��1�����з�Ӧ�Ļ�ѧ����ʽ�� ������ͭ������ (���������ԭ��)��Ӧ���ж�����Ϊ _______________ ��
��2��Ũ�����ڴ˷�Ӧ��������_________�Ժ�____________�ԡ�
��3�����б���NaHSO3��Һ�������dz�ȥ���лӷ��������ᡣ����һ��ʱ���������Һ��Ȼ���壬������Һ��ɫ����Ҫ������ֹͭ������ķ�Ӧ����ǡ���ķ����� _____________��
a������ͭ˿��ʹ���������� b����ȥ�ƾ��� c����ȥ������������
��4����Ӧֹͣ��װ����ȴ����������Һ����NaOH��Һ���۲쵽��������__________��
��5���������ŵ������� ____ ��
��6������Ũ������ͭ��Ӧ�����������ͨ��ͼ����װ��������Ӧ��װ��B�з����������� ����Ӧ�Ļ�ѧ����ʽΪ ______________________��װ��C�е������� ��������SO2�� �ԣ�װ��D�������� ��������SO2�� ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com