
分析 (1)碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,碳酸钙小于保留化学式;
(2)氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水;
(3)该反应属于氧化还原反应,反应中除了水、氯气之外其它物质都需要拆开;
(4)二氧化碳少量,反应生成碳酸钙沉淀和水;
(5)碳酸氢根离子恰好沉淀时,二者物质的量相等.
解答 解:(1)碳酸钙与盐酸反应生成二氧化碳气体、氯化钙和水,反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2)氢氧化钡与稀硫酸反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中氯气和水需要保留分子式,其它物质都需要拆开,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)向澄清石灰水中通入少量二氧化碳,反应生成碳酸钙沉淀和水,反应的离子方程式为:Ca2++2OH-+CO2═CaCO3↓+H2O,
故答案为:Ca2++2OH-+CO2═CaCO3↓+H2O;
(5)往碳酸氢钠溶液中加入Ba(OH)2溶液至溶液中的碳酸氢根离子完全转化为沉淀,碳酸氢钠与氢氧化钡按照物质的量1:1反应,反应的离子方程式为:Ba2++OH-+HCO32-═BaCO3↓+H2O,
故答案为:Ba2++OH-+HCO32-═BaCO3↓+H2O.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
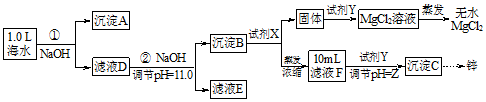
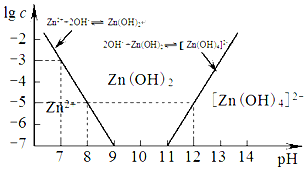
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
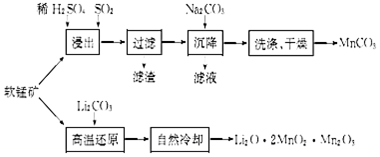
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 | 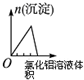 |  | 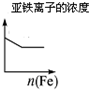 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
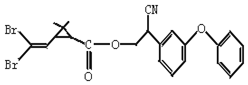
| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 有两种含氧官能团 | D. | 含苯环不含碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
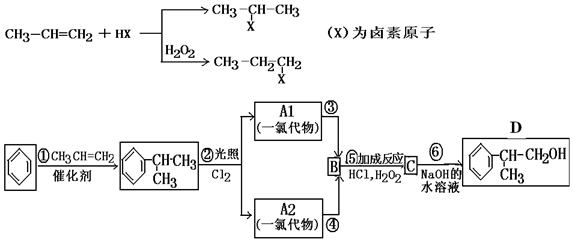
 ;
;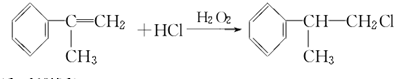 ;
;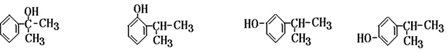 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 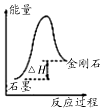 如图所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 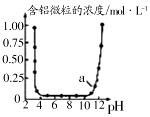 图表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 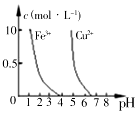 如图所示,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. | 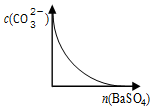 如图所示,在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com