
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
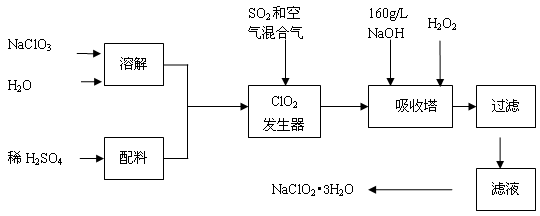
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2??3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。回答下列问题:
(1)发生器中发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
a. Na2O2 b. Na2S c.FeCl2
(4)从滤液中得到NaClO2??3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
科目:高中化学 来源: 题型:
 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
| O | n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化学 来源:2012届福建省三明市普通高中高三上学期联合命题考试化学试卷 题型:填空题
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年贵州省铜仁市高三第四次月考理综化学试卷(解析版) 题型:选择题
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
A.ClO2 B.NaClO4 C.HClO D. NaClO
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明市高三上学期联合命题考试化学试卷 题型:填空题
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
 HCl
+ HClO K=4.5×10-4
HCl
+ HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com