
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 | |
| C. | 负极反应为:2H++2e-═H2↑ | |
| D. | 该装置能将化学能转化为电能 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,硫酸为电解质时,正极析出氢气,原电池的正极可为较不活泼的金属或能导电的非金属,以此解答该题.
解答 解:A.构成原电池正负极的材料不一定都是金属,如锌、石墨和稀硫酸也能构成原电池,故A错误;
B.原电池中,易失电子的金属作负极,所以由铜锌作为电极与硫酸铜溶液组成的原电池中,Zn是负极,故B错误;
C.负极发生氧化反应,应为锌被氧化生成锌离子,负极电极反应为Zn-2e-=Zn2+,在正极上生成氢气,正极反应为2H++2e-═H2↑,故C错误;
D.原电池是将化学能转化为电能的装置,故D正确.
故选D.
点评 本题考查了原电池原理,明确原电池正负极的判断、电子流向、正负极上发生的反应等知识点即可解答,易错选项是A,原电池中正负极电极材料可能都不是金属,如氢氧燃料电池中电极材料都是石墨,为易错点.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW随着温度的升高而增大,说明水的电离过程是吸热的 | |
| B. | 弱电解质溶液稀释后,溶液中各种离子浓度一定都减小 | |
| C. | 某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 | |
| D. | 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | $\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ | D. | Ka(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和甲酸甲酯 | B. | 乙烯和环己烷 | C. | 甲醛和果糖 | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
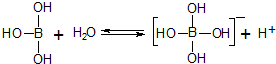
| A. | 硼酸加入水中抑制水的电离 | |
| B. | 硼酸是三元酸 | |
| C. | 硼酸与强碱在溶液中反应:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
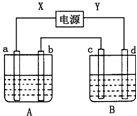 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com