
| A、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
| B、25℃时等浓度的CH3COONa和NaCN溶液,后者pH大 |
| C、HCN溶液和NaOH溶液混合后一定存在:c(H+)-c(OH-)=c (CN-)-c(Na+) |
| D、常温下将pH相同的CH3COOH和HCN溶液稀释相同的倍数时,前者pH变化小 |
| 10-14 |
| 10-m |
| 10-14 |
| 10-n |


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象 | 解释 |
| A | FeI2溶液中滴加过量氯水 | 溶液变黄 | 氯水氧化I-成碘单质,碘水呈黄色: 2I-+Cl2=I2+2Cl- |
| B | 苯酚钠溶液中通入少量CO2 | 出现白色浑浊 | 苯酚酸性弱于碳酸,反应生成苯酚: 2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| C | Ca(HCO3)2溶液中滴加过量NaOH溶液 | 出现白色沉淀 | Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D | 含有等浓度的Mg2+和Cu2+的废水液中逐滴加入少量NaOH溶液调节溶液pH=7 | 溶液中先出现蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2],因此Cu2+先沉淀;Cu2++2OH-=Cu(OH)2↓ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
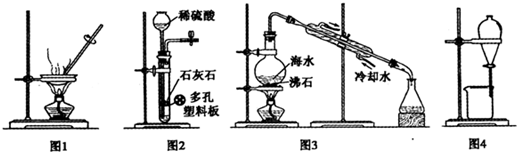
| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) |
| B、0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,所得溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) |
| D、pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- | ||
| B、使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | ||
C、含有0.1 mol?L-1 Fe3+的溶液:Na+、K+、SCN-、NO
| ||
| D、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:
如图,外接电源为Zn-MnO2干电池,甲乙为相互串联的两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验操作 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL |
| B、224mL |
| C、336mL |
| D、672mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com