
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- | |
| D. | 该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
分析 根据题意分析,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、CO32-、SO42-.第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,一定不存在Mg2+.第三份溶液利用发生的离子反应,经过计算、推得一定存在CO32-、SO42-,一定不存在Ba2+.
解答 解:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存,Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+第三份加足量BaCl2溶液后,得干燥沉淀经足量盐酸洗涤,干燥后,部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+,故选B.
点评 本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.


科目:高中化学 来源: 题型:选择题
| A. | 0.03molNO、0.01molNO2 | B. | 0.03molNO2、0.01molNO | ||
| C. | 0.06molNO | D. | 0.03molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
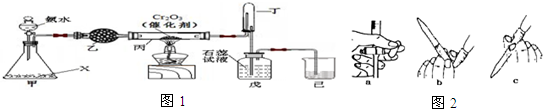
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
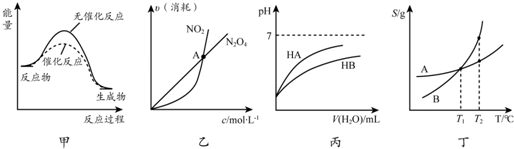
| A. | 由甲可知:使用催化剂不影响反应热 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 | |
| D. | 由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 污染物 | 二氧化硫 | 甲醛 | 氮氧化物 | 悬浮颗粒物 |
| 来源 | 雷电时空气中产生 | 人造家具、用具 | 燃煤、汽车尾气 | 燃煤、施工 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 化合物 | A | B | C | D |
| Y | CuSO4 | Fe2O3 | SiO2 | FeCl3 |
| W | FeSO4 | Al2O3 | CO | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的丙酮作为固定相,水作为流动相 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com