

分析 (1)根据流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠;
(2)CuS与氧气反应生成黑色氧化铜和二氧化硫气体;
(3)Na2S2O5中硫元素的化合价为+4价,生成二氧化硫化合价没变;
(4)氧化铜与硫酸反应生成硫酸铜,结晶得出硫酸铜晶体;
(5)反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2 SO2+H2O=2NaHSO3+CO2,为了控制杂质,二氧化硫与碳酸氢钠应按反应方程式中比例关系反应;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液,并用品红(或酸性高锰酸钾)检验是否除净,或直接用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净.
解答 解:(1)流程确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2,
故答案为:2CuS+3O2 $\frac{\underline{\;高温\;}}{\;}$2CuO+2SO2;
(3)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为:S2O52-+2H+=2SO2↑+H2O,
故答案为:S2O52-+2H+=2SO2↑+H2O;
(4)上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,副产品X的化学式是CuSO4•5H2O,
故答案为:CuSO4•5H2O;
(5)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1,检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用的澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液,并用品红(或酸性高锰酸钾)检验是否除净,或直接用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,检验产品中含有碳酸钠杂质所需试剂是①③⑥或①②③⑥,
故答案为:2:1;①③⑥或①②③⑥.
点评 本题考查了物质置制备的实验方案分析,主要是物质性质的理解应用,离子方程式书写方法,注意试剂的选择和实验操作的目的,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
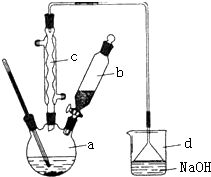 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某油脂化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及其氧化物,其他不溶杂志(3.3%).由含镍废催化剂制取NiSO4.7H20的流程如图:
某油脂化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及其氧化物,其他不溶杂志(3.3%).由含镍废催化剂制取NiSO4.7H20的流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com