
【题目】已知aAm+与bBn﹣具有相同的核外电子排布,则下列关系正确的是( )
A.a=b+m+n
B.a=b﹣m+n
C.a=b+m﹣n
D.a=b﹣m﹣n
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是
2NO2(g),体系中各物质浓度随时间变化如图所示,则下列叙述错误的是

A. 若温度升高,混合气体的颜色变深
B. 在该温度下反应2NO2(g)![]() N2O4(g)的平衡常K为25/9
N2O4(g)的平衡常K为25/9
C. 反应达平衡后,将反应容器的容积减少一半,平衡向正反应方向移动
D. 反应达平衡后,向此容器中通入NO2气体,则c(NO2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q都是短周期主族元素,其中Z原子的最高正价与最低负价的代数和为4;X与Z同族,Y与X同周期,Q原子的电子总数等于其电子层数的3倍,W与Y、Z不同周期;X、Y、Z三种元素的族序数之和为17。
(1)Z的简单离子结构示意图为__________________。
(2)写出含有10个中子的X原子的核素符号_____________。
(3)红热的Q单质可以与Z的最高价氧化物的水化物的浓溶液反应,写出该反应的化学方程式___________________。
(4)Y的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(5)X和Z两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的是______(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)下列关于土述元素说法正确的是_________。
A.X、Y、Q都能与W形成10电子分子
B.Y的最高价氧化物对应水化物能与Y的简单氢化物反应生成盐
C.X可以分别与另外四种元素最多各形成两种氧化物
(7) Na在X2中燃烧所得产物的化学式是_______,该物质中存在的化学键类型有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们用DNA制造出一种臂长只有7nm的纳米镊子,这种镊子能钳起分子或原子,并对它随意组合.下列分散系中,分散质微粒直径与纳米粒具有相同数量级的是( )
A.溶液
B.胶体
C.悬浊液
D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图。下列说法正确的是( )
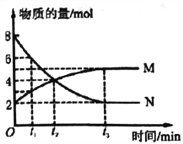
A. M、N之间转化的反应方程式为M =2N
B. t2时刻,反应达到平衡,正、逆反应速率达到相等
C. t3时刻,M的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
D. t1时刻,在容器内气体M和N的物质的量浓度之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A,1 mol能与2 mol HCl完全加成生成B,B上的氢原子被Cl原子完全取代需要8 mol Cl2,则A可能是
A. 丙炔 B. 2-丁炔 C. 1-丁烯 D. 2-甲基丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
②一定温度,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;升高温度,K值_______(填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;升高温度,K值_______(填“增大”、“减小”或“不变”)。
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。
(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。

同温度下CO2的平衡转化率________(填“大于”或“小于”)CH4的平衡转化率,其原因是_______________________________________________。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。则:
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。则:
①压强:p1_____p2(填“>”、“=”、“<”,下同);y点:v(正)_____v(逆)。
②已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图丙所示。该反应的化学方程式为____________________________________________。

(4)CO常用于工业上冶炼金属,图丁是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是_________。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原因是( )
A.胶体的电泳 B.血液的氧化还原反应
C.血液中发生复分解反应 D.胶体的聚沉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com