
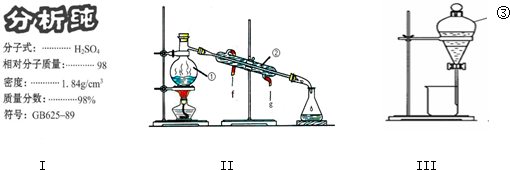
分析 (1)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓溶液的体积;
(2)熟悉仪器形状,说出其名称;
(3)分液沸点不同的液体混合物,可用蒸馏的方法,蒸馏时,应用温度计控制加热的温度;
(4)碘易溶于有机溶剂,可以利用萃取剂萃取,然后再分液分离碘;依据萃取剂条件解答.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容,用到的仪器:烧杯、量筒、玻璃棒、胶头滴管、100ml容量瓶,所以还缺少的玻璃仪器:100ml容量瓶;
浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×18.4mol/L=0.50mol/L×100mL,解得V=2.7mL;
故答案为:100ml容量瓶;2.7;
(2)上述装置Ⅱ中仪器的名称:②是冷凝管;③是分液漏斗;
故答案为:冷凝管 分液漏斗;
(3)分液沸点不同的液体混合物,可用蒸馏的方法,蒸馏时,应用温度计控制加热的温度,所以还缺少温度计,实验名称为蒸馏;
故答案为:温度计;蒸馏;
(4)碘易溶于有机溶剂,可以利用萃取剂萃取,然后再分液分离碘,实验名称为萃取分液;
萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
故答案为:萃取 分液;①②③.
点评 本题为基础实验,涉及到一定物质的量浓度溶液配制、物质分离的方法,明确配制一定物质的量浓度溶液的原理、蒸馏、萃取分液的原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
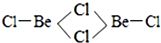
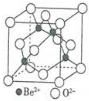
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
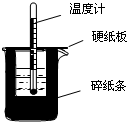 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com