
【题目】在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na、Mg 、AlB.Na、K 、Zn
C.Fe、Cu、AgD.Na、Ca、K
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
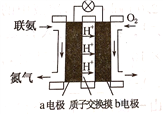
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治禽流感病毐目前人类面临的-个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸. 莽草酸有抗炎, 镇痛作用,也是合成对禽流感病爯毒有一定抑制作用的—种药物“达菲”的前体。莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是

A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间可能发生酯化反应
C. 莽草酸中含有苯环
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A能使溴的四氣化碳溶液褪色,其密度为相同条件下H2密度的14倍,完全燃烧产生等物质的里的CO2和H2O, A有如下转化关系,回答下列问题:
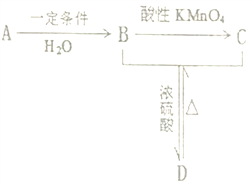
(1)A 的结构简式_______;B中含有的官能团名称______。
(2)A→B的反应类型为_______; C中含有的化学键类型_______。
(3)写出B+C→D的化学方程式_______;
(4)比A多一个碳的A的同系物与HCl气体反应得到的产物的同分异构体有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硫酸铝酸性溶液制备可溶性的碱式硫酸铝[Ala(SO4)b(OH)c],并用它对烟气进行脱硫处理的过程如图1: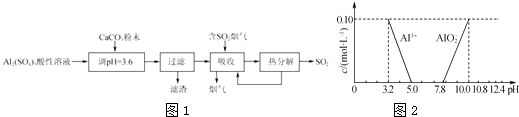
(1)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Ala(SO4)b(OH)c . 过滤时所用的玻璃仪器有、和烧杯,滤渣的主要成分为(填化学式).
(2)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”).
(3)Ala(SO4)b(OH)c中a、b、c的代数关系式为 .
(4)已知在常温下溶液中Al3+、AlO2﹣的浓度与溶液pH的关系如图2所示.为确定碱式硫酸铝的组成,进行如下实验:
①取2.18g碱式硫酸铝样品在空气中灼烧至恒重,样品质量减少了0.36g.
②另取2.18g碱式硫酸铝溶于水,调节溶液的pH到5.0~7.8.
③将②产生的沉淀过滤、洗涤、灼烧至恒重,称量剩余固体为1.02g.
请计算样品中Al3+和SO42﹣的物质的量之比(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.实验室制氨气的方法是加热NH4Cl
C.氨易液化,因此可用来作制冷剂
D.氨极易溶于水,因此可用来作喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是治疗疟疾的有效药物。用水提取青蒿索需采用较高温度,产品药效较差,改用低温、乙醚冷浸,药效显著提高。若把青蒿素制成双氢青蒿素,其治疗疟疾的效果比青蒿素更好。下列叙述中正确的是
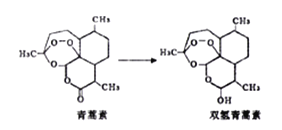
A. 青蒿素的分子式为C15H21O5 B. 双氢青蒿素的水溶性小于青蒿素
C. 青蒿素生成双氢青蒿素属于氧化反应 D. 低温可以减少药物提取过程中过氧键的断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用凯氏定氮法(Kjeldahl method)来测定农产品中氮的含量,测定过程如下:
I.用热浓硫酸处理0.25g谷物样品,把有机氮转化为铵盐。
II.用下图所示装置处理上述铵盐(夹持装置略去)。
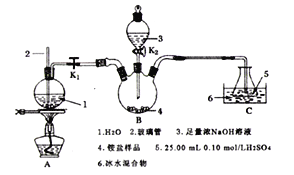
回答下列问题:
(1)实验前要检验B装置的气密性,具体操作为______________________________。
(2)盛放氢氧化钠溶液的仪器名称为__________________;玻璃管2的作用是___________________;圆底烧瓶中碎瓷片的作用是_________________________________________。
(3)将“谷物处理后所得的铵盐”加入三颈瓶中,打开玻璃塞、旋开K2,加入足量氢氧化钠溶液,关闭K2,打开K1,点燃酒精灯使水蒸气进入B装置。
①B装置中反应的离子方程式为_______________________________。
②C装置冰水混合物的作用是__________________________________。
III.滴定、计算氮的含量
(4)取下锥形瓶,加入指示剂,用0.10mol/L的NaOH溶液滴定,重复滴定3次,平均消耗19.30mLNaOH溶液。
①该滴定的指示剂应选择____________________。
a.甲基橙 b.配酞 c.甲基橙或酚酞
②该谷物样品中氮的百分含量为_____________。(保留2位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com