
����Ŀ��ij�¶�ʱ����һ���ݻ�Ϊ2 L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2����Ӧ��ʼ��2 min������Z�ķ�Ӧ����Ϊ_________��
��3����X��Y��Z��Ϊ���壬��Ӧ�ﵽƽ��ʱ��
��ѹǿ�ǿ�ʼʱ��________����
������ʱ�������������СΪԭ���� 0.5�����ﵽƽ��ʱ���������¶Ƚ�����(���������������Ƚ���)����÷�Ӧ������ӦΪ______��Ӧ(��������������������)��
��4����XΪ���塢Y��ZΪ���壬��÷�Ӧ��ƽ�ⳣ������ʽΪ__________________��
���𰸡� 3X��Y![]() 2Z 0.05 mol��L��1��min��1 0.9 ���� K =c2(Z)/ c(Y)
2Z 0.05 mol��L��1��min��1 0.9 ���� K =c2(Z)/ c(Y)
��������(1). ��ͼ��֪���ڸ÷�Ӧ��X��Y�����ʵ�����С��Z�����ʵ���������X��YΪ��Ӧ�ZΪ������ҡ�n(X):��n(Y):��n(Z)=0.3mol:0.1mol:0.2mol=3:1:2����÷�Ӧ�Ļ�ѧ����ʽΪ��3X��Y![]() 2Z���ʴ�Ϊ��3X��Y
2Z���ʴ�Ϊ��3X��Y![]() 2Z��
2Z��
(2). ��Ӧ��ʼ��2 minʱ��������Z��ʾ�ķ�Ӧ����Ϊv(Z)=  =0.05 mol��L��1��min��1���ʴ�Ϊ��0.05 mol��L��1��min��1��
=0.05 mol��L��1��min��1���ʴ�Ϊ��0.05 mol��L��1��min��1��
(3). ��. ��X��Y��Z��Ϊ���壬��ͬ��ͬ������ܱ������У���Ӧ�ﵽƽ��ʱ��ѹǿ�뷴Ӧ��ʼʱ��ѹǿ֮�ȵ���ƽ��ʱ���������ʵ����뷴Ӧ��ʼʱ���������ʵ���֮�ȣ���ͼ��֪����Ӧ��ʼʱ���������ʵ���Ϊ2mol���ﵽƽ��ʱ���������ʵ���Ϊ(0.9+0.7+0.2)mol=1.8mol���� ![]() =
=![]() =
=![]() =0.9���ʴ�Ϊ��0.9��
=0.9���ʴ�Ϊ��0.9��
��. �ɷ�Ӧ3X��Y![]() 2Z��֪���÷�ӦΪ�������ʵ������ٵĿ��淴Ӧ���������������СΪԭ���� 0.5����������ѹǿ����ƽ�������ƶ�����ʱ�������¶Ƚ��ͣ�˵������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
2Z��֪���÷�ӦΪ�������ʵ������ٵĿ��淴Ӧ���������������СΪԭ���� 0.5����������ѹǿ����ƽ�������ƶ�����ʱ�������¶Ƚ��ͣ�˵������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(4). ��XΪ���塢Y��ZΪ���壬��Ӧ3X��Y![]() 2Z��ƽ�ⳣ������ʽΪ��K=c2(Z)/ c(Y)���ʴ�Ϊ��K=c2(Z)/ c(Y)��
2Z��ƽ�ⳣ������ʽΪ��K=c2(Z)/ c(Y)���ʴ�Ϊ��K=c2(Z)/ c(Y)��


 ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д� ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3��(����ɫ)��Cr(OH) 4�� (��ɫ)��Cr2O72��(�Ⱥ�ɫ)��CrO42�� (��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1��Cr3+��Al3+�Ļ�ѧ��������,��Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������_______�����ӷ���ʽ____________________________��
��2��CrO42����Cr2O72������Һ�п��ת���������£���ʼŨ��Ϊ1.0mol��L1��Na2CrO4��Һ��c(Cr2O![]() )��c(H��)�ı仯��ͼ��ʾ��
)��c(H��)�ı仯��ͼ��ʾ��

�ٵ���Һ������ǿ��ʱ����Һ��ɫ�仯���Ϊ��_________________��
����ͼ��֪����Һ��������CrO42����ƽ��ת����_________(�������С�����䡱)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42����ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H_____0(����ڡ���С�ڡ����ڡ�)����3���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl��������Ag+��CrO42������ש��ɫ����,ָʾ����ζ��յ㡣����Һ��Cl��ǡ�ó�����ȫ(Ũ�ȵ���1.0��105molL1)ʱ,��Һ��c(Ag+)___molL1����ʱ��Һ��c(CrO42��)����_____molL1 (��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȼ��a g��Ȳ����ʱ����1mol������̼�����Һ̬ˮ�����ų�����b kJ������Ȳȼ�յ��Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=��2b kJ��mol��1
B��C2H2��g��+![]() O2��g���T2CO2��g��+H2O��l����H=+2b kJ��mol��1
O2��g���T2CO2��g��+H2O��l����H=+2b kJ��mol��1
C��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=��4b kJ��mol��1
D��2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=+b kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������л�ѧ����ʽ��
��1��̼���������ȷֽ�ķ���ʽ________________________________________
��2��NO2����ˮ�����ķ�Ӧ____________________________________________
��3��NH3��O2�ķ�Ӧ_________________________________________________
��4��HNO3��������ȵķֽⷴӦ_______________________________________
��5��Cu��ϡHNO3�ķ�Ӧ_____________________________________________
��6��Cu��ŨH2SO4�ķ�Ӧ_____________________________________________
��7��C��ŨH2SO4�ķ�Ӧ _____________________________________________
��8��Mg��CO2�ķ�Ӧ ________________________________________________
��9��Al��Fe2O3���������µ����ȷ�Ӧ_____________________________________
��10��Al��NaOH��Һ�ķ�Ӧ___________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
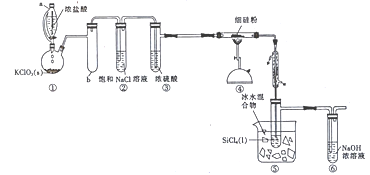
����Ŀ��SiCl4��һ�ֳ���������������֪SiCl4�ķе�Ϊ57.6�����ӷ���ˮ�⡣ʵ�����ù����������Ӧ�Ʊ�SiCl4��װ����ͼ��ʾ(�г�װ����ȥ)��
�ش��������⣺
��1��װ������������a�����Һ©�������ŵ���__________________�����ӵľ�֧�Թ�b��������_____________���������Ũ���ᷴӦ�Ļ�ѧ����ʽΪ______________________��
��2��ʵ�鿪ʼʱ���ȵ���Ũ������һ��ʱ����ٵ�ȼ���еľƾ��������Ŀ����_____________��
��3��װ�������ձ����ñ�ˮ������������____________________ ��
��4��ijͬѧ��Ϊ����װ�����в���֮������ʵ����װ�������Թ��п��ܻ���ְ�������ԭ����______________________ (�û�ѧ����ʽ��ʾ)����������Ľ��Ĵ�ʩ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2(g)��H2(g)�����������澭����ͼ��ʾ��������NH3������˵����ȷ����

A. �����ƻ��ľ�Ϊ���Լ�
B. ����Ϊ���ȹ���
C. ����NH2��H2����NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)��H>0
2NH3(g)��H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������VB2�������������Ŀǰ����������ߵĵ�أ����ʾ��ͼ���£��õ�ع���ʱ��ӦΪ��4VB2 + 11O2 = 4B2O3 + 2V2O5������˵����ȷ����
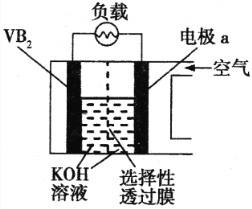
A���缫aΪ��ظ�����������ԭ��Ӧ
B��ÿ����1molVB2ת��6mol����
C����ع���ʱ��OH��缫a�ƶ�
D��VB2�������ĵ缫��ӦΪ��2VB2+22OH��22e��V2O5+2B2O3+11H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W���������������ת����ϵ������X��WΪ���ʣ�Y��ZΪ�����δ�г���Ӧ������
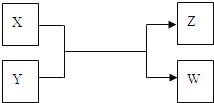
����Z�������г��õĵ�ζƷ��W��������Һ��������
��1�������£�X����ɫ��____________��
��2����ҵ��Z�ж�����;���û�ѧ����ʽ��ʾZ��һ����;_________________________��
��3�����������õ�Z�����˵���أ�����X��Y��Һ��Ӧʱ���Եõ����ֵ����Σ��˷�Ӧ�����ӷ���ʽ��______________________________________��
����X�ǹ�ҵ���������Ľ������ʣ�Z��һ�־��д��Եĺ�ɫ���壬��
��1��X��Y��Ӧ�Ļ�ѧ����ʽ��__________________________________��
��2����3.48g Z����50mL 4mol/L��ϡHNO3�г�ַ�Ӧ������112mL��NO����״��������Ӧ�����Һ�еμ�NaOH��Һ�ܲ�������������������࣬������Ҫ����2mol/L��NaOH��Һ_____mL ����ȷ��0.1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������Һ�д���������ǣ� ��
A.Na����Mg2����Br����SO42-B.K����Ca2����HCO3-��OH-
C.Fe2����H����SO42-��NO3-D.Na����Cu2����Cl-��S2-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com