
下列离子反应方程式正确的是( )
A.往FeCl3溶液中加入Fe粉:Fe3+ +Fe=2Fe2+
B.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH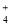
D.碳酸氢钠溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO +2H2O
+2H2O
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A. 组成元素相同,各元素质量分数也相同的不同物质属于同系物
B. 分子式相同的不同物质一定是同分异构体
C. 相对分子质量相同的不同物质一定是同分异构体
D. 通式相同的不同物质一定属于同系物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省岳阳市华容县四校高三联考二化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分CuFeS2)为原料制备CuS04.5H2O的主要流程如下:
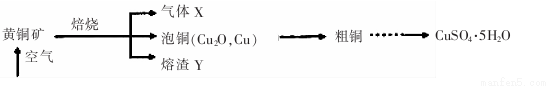
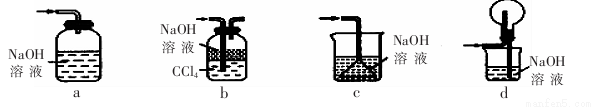
(1)下列装置不能用于吸收气体X的是 。(填代号)。
(2)熔渣Y的成分为Fe203和Fe0,选用提供的试剂,设计实验验证熔渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMn04溶液、NaOH溶液、氯水。
①从上述提供的试剂中选择实验验证所需药品 。
②写出验证过程中所发生的氧化还原反应的离子方程式 。
(3)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中HNO3与H2S04的最佳物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省岳阳市华容县四校高三联考二化学试卷(解析版) 题型:选择题
下列有关非金属及其化合物的说法正确的是( )
A.硅酸可使紫色石蕊试液变红色
B.二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C.可用锌粒与稀硝酸反应制备氢气
D.液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上9月调研化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl--2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上9月调研化学试卷(解析版) 题型:选择题
已知异丙苯的结构简式如图,下列说法错误的是( )

A. 异丙苯的分子式为C9H12
B. 异丙苯的沸点比苯高
C. 异丙苯和苯互为同系物
D. 异丙苯中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:实验题
在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L?1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L?1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L?1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L?1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L?1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:填空题
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
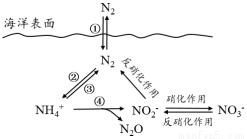
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
 NH4++5O2
NH4++5O2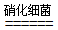 2NO2-+
2NO2-+ H++
H++ +
+
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。
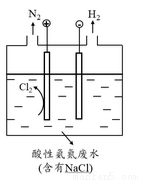
结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
水热法制备Fe2O3纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,关于该反应下列说法正确的是
A.H2O和S4O62-都是还原产物
B.1molFe2+参加反应时,转移2mol电子
C.Fe2+、S2O32-都是还原剂
D.x=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com