
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:解答题
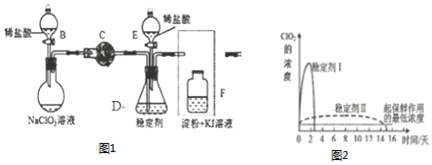
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | CH2=CH2+H2$→_{△}^{催化剂}$CH3-CH3 | ||
| C. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ | D. |  +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊. | 碳酸的酸性比苯酚的强 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2S O4)<Ksp(Ca2S O4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe2+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
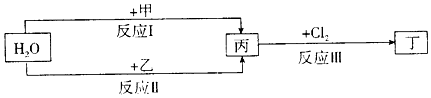
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
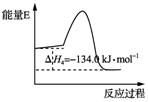 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )
如图是一种新型燃料电池装置示意图,该电池以溶有电解质A的稀盐酸为电解质溶液,它不仅能提供电能,还能起到固氮作用.下列对该电池的说法不正确的是( )| A. | 通入H2的电极为负极,A为NH4Cl | |
| B. | 每转移0.1mol电子,消耗1.12L H2 | |
| C. | 溶液中H+向通入N2的一极移动,Cl-向通入H2的一极移动 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+═2NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com