
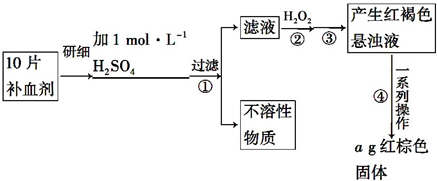
分析 (1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液反应生成白色沉淀迅速变化为灰绿色,最后变化为红褐色;
(2)步骤②加入过量H2O2的目的是,过氧化氢氧化亚铁离子;
(3)根据氧化铁的质量计算铁元素的质量.注意ag氧化铁含有的铁元素质量为10片含有的铁元素质量;
(4)①用酸性KMnO4溶液滴定也能进行铁元素含量的测定,是利用高锰酸钾溶液氧化亚铁离子定量关系测定;
②精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
③KMnO4溶液需要酸化,用于酸化的酸不能具有强氧化性氧化Fe2+,不能具有强还原性被高锰酸钾氧化,否则会影响高锰酸钾溶液的体积;
④高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,依据离子方程式定量关系计算亚铁离子物质的量,得到铁元素质量分数.
解答 解:(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液,生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色,反应的离子方程式和化学方程式为:Fe2++2OH-=Fe(OH)2↓,4 Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色;Fe2++2OH-=Fe(OH)2↓; 4 Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)步骤Ⅱ中发生反应是亚铁离子被过氧化氢氧化生成铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:使Fe2+全部转化为Fe3+;
(3)最后氧化铁为ag,氧化铁含有铁元素的质量为$\frac{112}{160}$×ag=0.7ag,故每片补血剂含铁元素的质量为$\frac{0.7a}{10}$=0.07ag,
故答案为:0.07a;
(4)①用酸性KMnO4溶液滴定也能进行铁元素含量的测定,是利用高锰酸钾溶液氧化亚铁离子定量关系测定,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,
故答案为:250mL容量瓶;
③稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选:B,
故答案为:B;
④高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5 1
n 0.1mol•L-1 ×0.1L
n=0.05mol
该补血剂中铁元素的质量分数=$\frac{0.05mol×56g/mol}{mg}$×100%=$\frac{2.8}{m}$×100%;
故答案为:$\frac{2.8}{m}$×100%.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等、氧化还原滴定应用,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 某物质不属电解质,就属于非电解质 | |
| B. | SO3溶于水可导电,SO3属于电解质 | |
| C. | 能导电的物质属于电解质,NaCl属于电解质,NaCl晶体可导电 | |
| D. | 已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) c(CH3COO-)c(CH3COOH) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 少量CO2气体通入苯酚钠溶液中:2 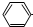 →O-+H2O+CO2→2 →O-+H2O+CO2→2 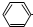 -OH+CO32- -OH+CO32- | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: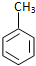 +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$ +3HNO3$→_{100℃}^{浓H_{2}SO_{4}}$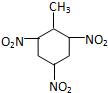 +3H2O +3H2O | |
| D. | 工业上通过苯与乙烯反应获得乙苯: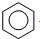 +CH2═CH2$→_{△}^{催化剂}$ +CH2═CH2$→_{△}^{催化剂}$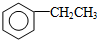 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

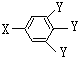
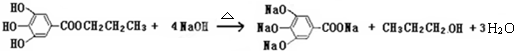
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(W)=3v(Z) | B. | 2v(X)=3v(Z) | C. | 2v(X)=v(Y) | D. | 2v(W)=3v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
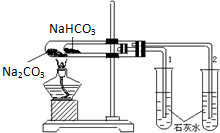 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com