
由铜、锌和稀硫酸组成的原电池中(图1):
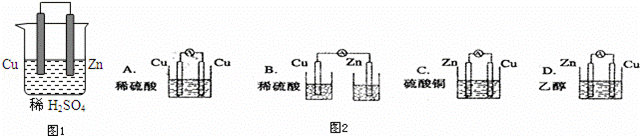
(1)锌是负极,电极反应式是 .铜是正极,电极反应式是 .总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)图2装置能够组成原电池是 .
考点: 原电池和电解池的工作原理.
分析: (1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应;
(2)铜、锌、稀硫酸原电池中,锌易失电子溶解发生氧化反应,铜作正极,正极上氢离子得电子生成氢气;
(3)根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答: 解:(1)铜、锌、稀硫酸原电池中,锌易失电子发生氧化反应而作负极,电极反应式为:Zn﹣2e﹣═Zn2+,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑,总反应为Zn+2H+=Zn2++H2↑,
故答案为:负;Zn﹣2e﹣═Zn2+;正;2H++2e﹣=H2↑;Zn+2H+=Zn2++H2↑;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑,所以铜极上可以观察到有气泡产生;锌易失电子发生氧化反应而作负极,电极反应式为:Zn﹣2e﹣═Zn2+,所以锌极可以观察到锌片逐渐溶解;
故答案为:有气泡产生;锌片逐渐溶解;
(3)A、两个电极材料相同且不能自发的进行氧化还原反应,故A错误.
B、没有形成闭合回路,故B错误.
C、符合原电池的构成条件,故C正确.
D、乙醇不是电解质溶液且不能自发的进行氧化还原反应,故D错误.
故选C.
点评: 本题考查了原电池原理以及形成原电池的条件,明确正负极的判断方法、正负极上电极反应即可解答,难度不大.


科目:高中化学 来源: 题型:
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液.
|
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
蓄电池在放电时起原电池作用,在充电时起电解池的作用.下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2则下列有关对爱迪生蓄电池的推断错误的是( )
|
| A. | 放电时正极附近pH增大 |
|
| B. | 充电时阴极的电极反应式为:Fe(OH)2+2e﹣═Fe+2OH﹣ |
|
| C. | 放电时电解质溶液中的阴离子向正极方向移动 |
|
| D. | 蓄电池的电极可浸入某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是()
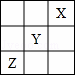
A. Z一定是活泼的金属元素
B. Y的最高价氧化物的水化物是一种强酸
C. Y的氢化物稳定性大于Z的氢化物稳定性
D. X、Y、Z各元素的最高正价与最低负价的绝对值之和均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中既属于氧化还原反应同时又是吸热反应的是()
A. Ba(OH)2•8H2O与NH4Cl反应 B. 镁与稀盐酸反应
C. 灼热的炭与CO2反应 D. 甲烷与O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 氢氧化钡与稀硫酸混合:SO42﹣+H++OH﹣+Ba2+=H2O+BaSO4↓
C. 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O
D. 石灰乳与Na2CO3溶液混合:Ca2++CO32﹣=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
已知多硫化钠Na2Sx(x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1:10,则x值是()
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列有关化学基本概念的依据正确的是( )
|
| A. | 置换反应:是否有单质参加 |
|
| B. | 纯净物与混合物:是否仅含有一种元素 |
|
| C. | 溶液与胶体:本质区别是分散质粒子的直径大小 |
|
| D. | 电解质与非电解质:物质本身是否具有导电性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com