
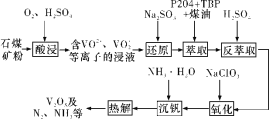
【题目】钒钢具有高强度、弹性优良、抗磨损、抗冲击等性能,可用于汽车和飞机制造。一种从石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如下图所示:
已知:
VO2+ | VO2+ | Fe2+ | Fe3+ | |
P2O4+TBP+煤油中的溶解度 | 很大 | 较小 | 0 | 很大 |
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有__________(任写一条);生成VO2+反应的离子方程式为_______。
(2)从整个流程来看,“还原”的目的为_______。
(3)实验室模拟“萃取”时,需用到的玻璃仪器有____________。
(4)“氧化”时发生反应的离子方程式为__________。
(5)上述流程中可以循环利用的物质有_________。
(6)全钒液流储能电池的工作原理为VO2++V3++H2O![]() VO2++V2++2H+。
VO2++V2++2H+。
①充电时,阳极的电极反应式为______;
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液中n(H+)________(填“增加”或“减少”)________mol。
【答案】适当升高反应温度、适当增大O2通入量、搅拌(其他合理答案均可,任写一条) 2V2O3+8H++O2=4VO2++4H2O 将VO2+还原为VO2+、Fe3+还原为Fe2+,利于后续萃取分离 分液漏斗、烧杯 6VO2++ClO3-+3H2O=6VO2++Cl-+6H+ P2O4+TBP+煤油、NH3(或NH3·H2O) VO2+-e-+H2O=VO2++2H+ 减少 2
【解析】
石煤(含SiO2、V2O3、V2O5和少量Fe2O3)与硫酸和氧气反应生成的主要是含有VO2+、VO2+、Fe3+,经过亚硫酸钠还原,变为VO2+、Fe2+,经过P2O4+TBP+煤油的萃取出VO2+,再用硫酸反萃取出VO2+,经过NaClO3的氧化,再加氨水沉钒,再热解得到V2O5。
⑴由流程图可知,“酸浸”时需加入O2和H2SO4,为加快反应速率,除了适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取适当升高反应温度、适当增大O2通入量、搅拌等措施;生成VO2+反应的离子方程式为2V2O3+8H++O2 = 4VO2++4H2O;故答案为:适当升高反应温度、适当增大O2通入量、搅拌(其他合理答案均可,任写一条);2V2O3+8H++O2=4VO2++4H2O。
⑵分析反应流程及表格数据可知,VO2+与Fe3+在P2O4+TBP+煤油中的溶解度很大,而VO2+与Fe2+在萃取剂中的溶解度较小,要除去含铁杂质,可将VO2+还原为VO2+、Fe3+还原为Fe2+,利于后续萃取分离;故答案为:将VO2+还原为VO2+、Fe3+还原为Fe2+,利于后续萃取分离。
⑶在“萃取”操作中,需用到的玻璃仪器有分液漏斗、烧杯;故答案为:分液漏斗、烧杯。
⑷“氧化”过程为加入NaClO3将VO2+氧化为VO2+,发生反应的离子方程式为6VO2++ClO3-+3H2O = 6 VO2++Cl-+6H+;故答案为:6VO2++ClO3-+3H2O = 6 VO2++Cl-+6H+。
⑸由流程图可知,该流程进行了“萃取”与“反萃取”,故萃取剂P2O4+TBP+煤油可循环使用,另外“热解”产生的NH3可配制成NH3·H2O溶液,用于“沉钒”操作;故答案为:P2O4+TBP+煤油、NH3(或NH3·H2O)。
⑹①充电时阳极发生氧化反应,其电极反应式应为VO2+-e-+H2O = VO2++2H+。②放电时正极反应式为VO2++e-+2H+= VO2++H2O,负极反应式为V2+-e-=V3+,故当外电路转移2mole-时,正极反应消耗4molH+,负极区有2molH+通过质子交换膜移向正极区,故正极区溶液中n(H+)将减少2mol;故答案为:VO2+-e-+H2O=VO2++2H+;减少;2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。在漂白、电镀等方面应用也很广泛。某兴趣小组设计了如下图所示的装置制备NaNO2(A中加热装置已略去)。
已知:室温下,①2NO+Na2O2===2NaNO2
②酸性条件下,NO 或NO2-都能与MnO4-反应生成NO3-和Mn2+
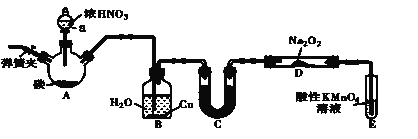
(1)A中发生反应的化学方程式为_________________________________。
(2)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N 2的作用是______________。
(3)装置B中观察到的主要现象为_________________
(4)①为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___________(填字母序号)。
A.P2O5 B.无水CaCl2 C.碱石灰 D.浓硫酸
②如果取消C装置,D中固体产物除NaNO2外,可能含有的副产物有________ 写化学式)。
(5)E中发生反应的离子方程式为____________。
(6)将1.56g Na2O2完全转化为NaNO2,理论上至少需要木炭__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 、
、![]() 和
和![]() 制备
制备![]() ,设计流程如图:
,设计流程如图:![]() 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入![]()

已知:常温时部分难溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为________。
发生反应的离子方程式为________。
(3)加入![]() 固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
(4)丙同学认为向滤液C中滴加![]() 溶液的过程中可能会生成
溶液的过程中可能会生成![]() 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为![]() ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数![]() ________
________![]() 填数值
填数值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名称为________。
(6)如图是小组同学将![]() 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度![]() 变化的曲线
变化的曲线![]() 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在![]() 以下不变
以下不变![]() 。
。
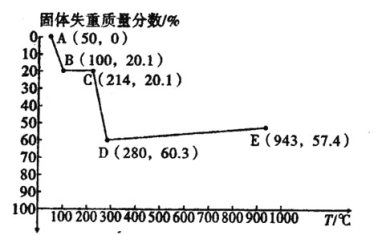
试根据各点的坐标![]() 近似值
近似值![]() 回答下列问题:
回答下列问题:
①![]() 的化学方程式为________。
的化学方程式为________。
②从D点到E点过程中固体失重的质量分数下降的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
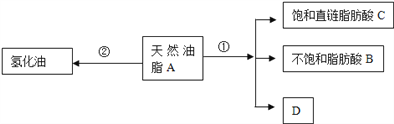
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T型化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是( )
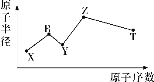
A.原子半径和离子半径均满足:Y<Z
B.简单氢化物的沸点和热稳定性均满足:Y>T
C.最高价氧化物对应的水化物的酸性:T<R
D.常温下,0.1mol·L-1由X、Y、Z、T四种元素组成的化合物的水溶液的pH一定大于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:

(1)“酸浸”过程,为提高铁和镍元素的浸出率,可采取的措施有___________(写出两种)。
(2)“过滤Ⅰ”滤渣的主要成分是______。
(3)“氧化”过程欲使0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为________ mol。
(4)“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,写出该反应的化学方程式______。若碳酸钠过多会导致生成的沉淀由黄钠铁矾转变为_____(填化学式)。
(5)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如下图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为_____。写出该条件下制备纳米镍粉同时生成N2的离子方程式_____。

(6)高铁酸盐也是一种优良的含铁净水剂,J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为______;Deininger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:△H>0,p2>p1
反应Ⅰ:△H>0,p2>p1
B. 反应Ⅱ:△H>0,T1>T2
反应Ⅱ:△H>0,T1>T2
C. 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
D. 反应Ⅳ:△H<0,T2>T1
反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
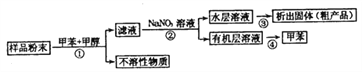
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com