
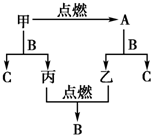
 A��B��C�����ֳ����Ļ����AΪ����ɫ���壮����֮���ת����ϵ��ͼ��ʾ��
A��B��C�����ֳ����Ļ����AΪ����ɫ���壮����֮���ת����ϵ��ͼ��ʾ������ �ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壬�ж�AΪNa2O2������ת����ϵ��֪��ΪNa����ΪO2����A+B=C+�ң��ƶ�BΪH2O��CΪNaOH�����ݼ�+B=C+�������ΪH2���ݴ˽��
��� �⣺�ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壬�ж�AΪNa2O2������ת����ϵ��֪��ΪNa����ΪO2����A+B=C+�ң��ƶ�BΪH2O��CΪNaOH�����ݼ�+B=C+�������ΪH2��
��1��������������֪��AΪNa2O2������Ϊ�������ƣ�
�ʴ�Ϊ���������ƣ�
��2����ԭ�������Na��Na2O2�����ʵ����ֱ�Ϊx��y����
2Na+2 H2O=2 NaOH+H2��
2 2 1
x x 0.5x
2 Na2O2+2H2O=4 NaOH+O2��
2 4 1
y 2y 0.5y
2 H2+O2$\frac{\underline{\;��ȼ\;}}{\;}$2 H2O
2 1
0.5x 0.5y
��x=2y
����23g/mol��x+78g/mol��y=11.2g
�������x=0.2��y=0.1
��n��NaOH��=x+2y=0.4mol����c��NaOH��=$\frac{0.4mol}{0.1L}$=4mol/L��
�ʴ�Ϊ��4mol/L��
��3����ΪNa��BΪH2O������B��Ӧ�����ӷ�Ӧ����ʽΪ2Na+2H2O�T2 Na++2OH-+2H2 ����AΪNa2O2��A��CO2��Ӧ�ķ���ʽΪ2Na2O2+2CO2�T2Na2CO3+O2��
CΪNaOH��C��Al��Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O�T2 AlO2-+3H2 ����
�ʴ�Ϊ��2Na+2H2O�T2 Na++2OH-+2H2 ����2Na2O2+2CO2�T2Na2CO3+O2��2Al+2OH-+2H2O�T2 AlO2-+3H2 ����
���� ���⿼�������ƶϣ��漰NaԪ�ػ��������ʣ��Ѷ��еȣ�ע��Ի���֪ʶ���������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ﶼ����ͬ�ַ��ӹ��� | |
| B�� | ����������ǵ��ʣ�Ҳ�����ǻ����� | |
| C�� | ��Ȫˮ�Ǵ����� | |
| D�� | �����������ͬ��Ԫ����ɵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
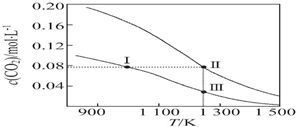
| A�� | ��ӦCO2��g��+C��s���T2CO��g���ġ�S��0����H��0 | |
| B�� | ��ϵ����ѹǿp����p����״̬��2p����״̬�� | |
| C�� | ��ϵ��c��CO����c��CO��״̬��2c��CO��״̬�� | |
| D�� | �淴Ӧ����v����v����״̬��v����״̬�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe3+ | B�� | Fe2+ | C�� | Al3+ | D�� | Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
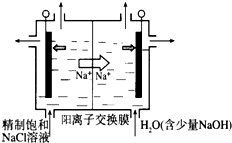
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�11.2L���������ķ�����Ϊ0.5NA | |
| B�� | ��״���£�22.4L O2��44.8L SO2��ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ4NA | |
| C�� | ��Ϊ0.1mol��H3O+��OH-�к��еĵ�����Ŀ��Ϊ0.9NA | |
| D�� | 2.4g O2��O3����ɵĻ����������������ԭ����ĿΪ0.15NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com