
| 20.02+19.98 |
| 2 |
| 0.56g |
| 5g |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
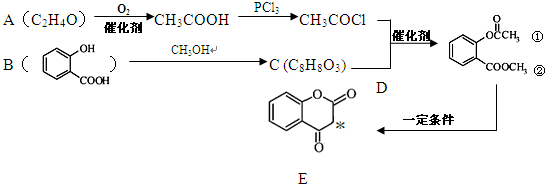
 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:

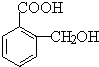 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
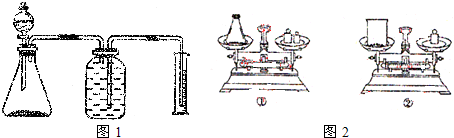
查看答案和解析>>
科目:高中化学 来源: 题型:
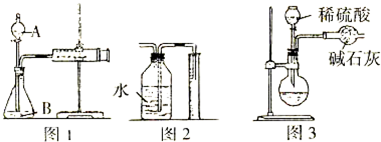
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.
)是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.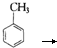
查看答案和解析>>
科目:高中化学 来源: 题型:
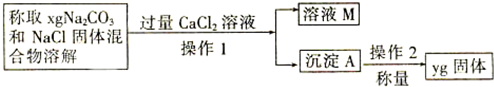
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁强化酱油可通过膳食补充人体所需的铁元素 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应 |
| C、一定浓度的双氧水可用于伤口的消毒 |
| D、蔬菜中含有维生素C,生吃新鲜蔬菜要比熟吃时维生素C的损失大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 通入O2 |
| 通入空气吹出Br2 |
| 用X吸收 |
| 通入Cl2 |
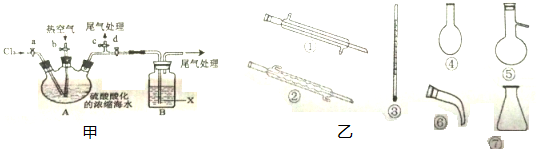
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com