
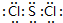 ;
;分析 X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be,X与W、Y与Z两对原子的最外层电子数之和为9,则W的最外层电子数为7,则W为F或Cl元素,且X、Y、Z、W原子序数依次增大,四种元素中有两种金属元素,则W不能为F元素,故W为Cl;Y、Z处于第三周期,则只能Y为金属元素,且能与氢氧化钠溶液反应,故Y为Al;则Z原子最外层电子数为9-3=6,故Z为S元素,据此解答.
解答 解:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be,X与W、Y与Z两对原子的最外层电子数之和为9,则W的最外层电子数为7,则W为F或Cl元素,且X、Y、Z、W原子序数依次增大,四种元素中有两种金属元素,则W不能为F元素,故W为Cl;Y、Z处于第三周期,则只能Y为金属元素,且能与氢氧化钠溶液反应,故Y为Al;则Z原子最外层电子数为9-3=6,故Z为S元素.
(1)SCl2各原子均满足8电子稳定结构,S原子与Cl原子之间形成1对共用电子对,电子式为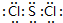 ,故答案为:
,故答案为: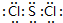 ;
;
(2)工业电解熔融氧化铝生产单质Al,说明氧化铝是离子化合物,故答案为:离子;
(3)Al与浓的NaOH溶液反应的化学方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Be与Al化学性质相似,则Be与浓的NaOH溶液反应所得盐的化学式为Na2BeO2,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Na2BeO2.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,解题的突破口是“X原子的最外层电子数与次外层电子数相等”.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: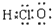 | |
| D. | NaCl的电子式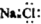 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯硝化生成三硝基甲苯 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯燃烧带有浓厚的黑烟 | D. | 甲苯与氢气可以生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
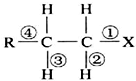
| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
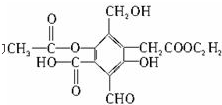
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
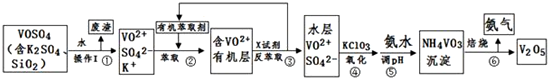
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com