
A.2 min B.3 min C.4 min D.5 min
| 设所经过的时间为x
N2 + 3H2  
练习册系列答案
 好成绩1加1期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案 金状元绩优好卷系列答案
相关习题
科目:高中化学 来源: 题型: I.在容积相同的两个容器A和B中,保持温度为423K,同时向A、B中分别加入amol、bmol HI (a>b),反应2HI?H2+I2(g)达到平衡后,两容器中各物质的反应速率VA > > VB;平衡时c(I2)B平衡时,I2蒸汽在混合气体中的体积百分含量:A容器= = B容器:HI的平衡分解率:aA= = aB.Ⅱ.合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);在一定温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器的压强为开始时的 0.55 0.55 倍.若保持同一反应温度将起始物质改为a mol CO、b mol H2、c molCH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b满足的关系为关系为2a+2.5=b 2a+2.5=b ,且欲使开始时可逆反应向逆反应方向进行,c的取值范围是2.25<c<2.5 2.25<c<2.5 .查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 元素周期表、平衡移动原理是化学反应原理中的重要内容.请回答下列问题:现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子. 请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关): (1)①A~F六种元素原子,原子半径最大的是 D D (填序号).②A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 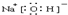 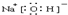 ③B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: HClO和NH3(NH3?H2O) HClO和NH3(NH3?H2O) .④A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: Cu+2H2SO4(浓)
Cu+2H2SO4(浓) .
(2)在一定温度下,向一个体积为1.0L的密闭容器中,通入3mol SO2 和2mol O2及固体催化剂,使之反应:2SO2(g)+O2(g)  2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%. 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.①加入3mol SO2 和2mol O2 发生反应,达到平衡时放出的热量为 98.3KJ 98.3KJ ②该温度下反应的平衡常数是 0.167 0.167 .查看答案和解析>> 科目:高中化学 来源: 题型: (2011?崇明县二模)在一定温度下,向一个容积不变的容器中,加入2mol N2和8mol H2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的80%,该反应的热化学方程式为:N2(g)+3H2(g)→2NH3(g)+92kJ.下列叙述中正确的是( ) 查看答案和解析>> 科目:高中化学 来源: 题型: 在一定温度下,向一个容积不变(1L)的密闭容器中,加入3mol PCl3和4mol Cl2使之发生反应PCl3(g)+Cl2(g)?PCl5(g),平衡时容器内压强为开始时的
计算并回答: (1)平衡时,容器内气体密度是开始时的 1 1 倍,气体平均相对分子质量是开始时的
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5.欲使平衡时PCl5的体积分数为
a+c=3 a+c=3 ,b+c=4 b+c=4 .欲使开始时反应向逆方向进行,则a的取值范围为 0≤a<2 0≤a<2 ,b的取值范围为1≤b<2 1≤b<2 ,c的取值范围为1<c≤3 1<c≤3 .查看答案和解析>> 科目:高中化学 来源: 题型: (1)俄罗斯最近研制的一种名为“阿采塔姆”的新型燃料,可大幅度提高火箭运载量,这种燃料的成分是乙炔和液氨. ①已知:25℃,101KPa下,1g乙炔完全燃烧生成CO2(g)、H2O(l)放出50kJ的热,试写出表示乙炔燃烧热的热化学方程式 ②又知热化学方程式: N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1 H2O(l)═H2O(g)△H=+44kJ?mol-1 ⅰ试完成以下热化学方程式: 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H= ⅱ在一定温度下,向一个容积不变的容器中,通入5molN2(g)和H2(g)的混合气体,并装入固体催化剂,使之反应.平衡时,容器内的压强为起始时的80%,则反应过程中共放热 (2)已知:CO2 (g)+H2(g)?CO(g)+H2O(g)的平衡常数随温度的变化如下表:
①该反应逆反应为 ②容器容积不变,850℃时,能表明反应达到平衡的是 A.容器中气体密度不变 B.容器中气体的平均相对分子质量不变 C.容器中H2的浓度不变 D.υ正(H2O)=υ逆(CO2) ③容器容积不变,850℃时各物质平衡浓度为 c(CO2)=0.4mol?L-1 c(H2)=0.1mol?L-1 c(CO)=xmol?L-1 c(H2O)=0.2mol?L-1 若用a、b、c、d、分别表示CO2、H2、CO、H2O的起始浓度. ⅰ则x= ⅱ则a、b应满足的关系是 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |