
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为NaOH溶液,则丁可能是CO2B.若乙为Al(OH)3,则丁可能是NaOH
C.若甲为Fe,则丁可能是Cl2D.若丁是O2,则甲可能为C
科目:高中化学 来源: 题型:
【题目】苯是一种非常重要的化工原料,利用苯可以合成多种有机物。有人设计了合成芳纶、PF树脂和肉桂酸乙酯的路线,如下图:
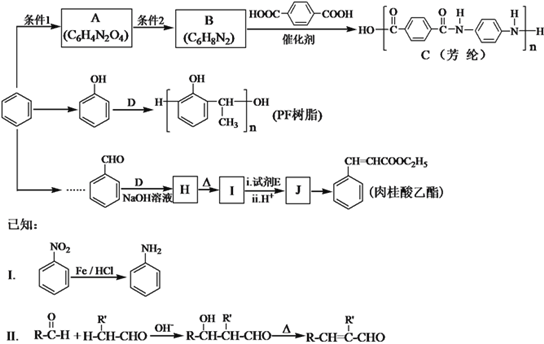 回答下列问题:
回答下列问题:
(1)反应条件1是____________。
(2)B分子中的官能团的名称为_________,B→C的反应类型为____________。
(3)D的结构简式为________,生成PF树脂的化学方程式为_______________。
(4)试剂E是_________。
(5)由J合成肉桂酸乙酯的化学方程式为 _____________________。
(6)写出同时满足下列条件的肉桂酸乙酯的一种同分异构体__________。
①苯环上仅有2个取代基且处于对位
②能发生水解反应和银镜反应,其中一种水解产物遇FeCl3溶液显色
③存在顺反异构
(7)以D为原料,选用必要的无机试剂合成乙二醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
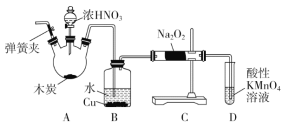
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)A装置中反应的化学方程式为_________。
(2)B装置中主要的现象是________。
(3)检验C装置产物中有亚硝酸钠的方法是_______。
(4)D装置中反应的离子方程式为________。
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(6)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________(填序号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯 c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯e.关闭分液漏斗欧旋塞 f.停止通入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A. 1mol/L B. 2 mol/L C. 0.5 mol/L D. 1.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种物质:①盐酸;②Na2O;③Na2O2;④Al(OH)3;⑤Na2CO3;⑥H2O;⑦CO2;⑧乙醇;⑨Cu;⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是
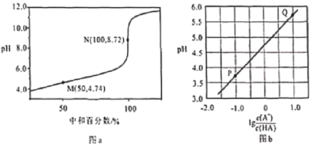
A. 当滴定至溶液呈中性时,c(A-)>c(HA)B. N点,c(Na+)·c(A-)=![]()
C. Ka(HA)的数量级为10-5D. P-Q过程中,水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
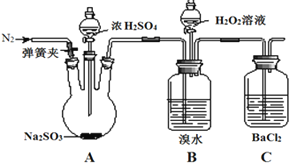
实验操作 | 实验现象 |
i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________。
(2)该实验可以证明SO2具有_________性;H2O2的氧化性_________Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________,B中重新变成红棕色的原因____________________________________(均用离子方程式表示)。
(4)C中产生的白色沉淀是______。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
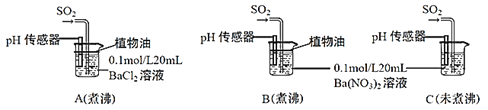
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________。若实验B、C中通入足量的SO2后,溶液酸性:B_________C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:
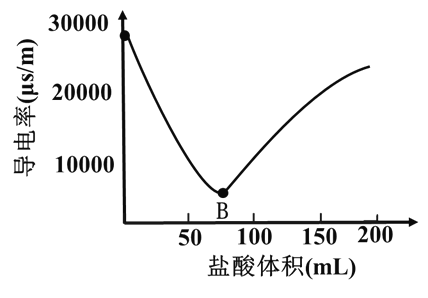
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。
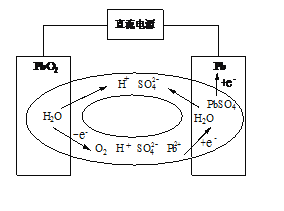
(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com