
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 pH<7的NaHSO3溶液中:c(HSO)>c(H2SO3)>c(SO![]() )
)
B. 10 mL 0.5 mol·L-1 CH3COONa溶液与10 mL 1 mol·L-1盐酸混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
C. 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO)+c(OH-)+c(CO![]() )
)
D. c(NH)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
【答案】B
【解析】0.1 mol·L-1的NaHSO3溶液pH<7,说明HSO的电离大于水解,所以c(HSO)>c(SO![]() )>c(H2SO3),故A错误; 10 mL 0.5 mol·L-1 CH3COONa溶液与10 mL 1 mol·L-1盐酸混合后,溶质是等物质的量的氯化钠、醋酸、氯化氢,溶液呈酸性,c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-),故B正确;根据物料守恒,在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO
)>c(H2SO3),故A错误; 10 mL 0.5 mol·L-1 CH3COONa溶液与10 mL 1 mol·L-1盐酸混合后,溶质是等物质的量的氯化钠、醋酸、氯化氢,溶液呈酸性,c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-),故B正确;根据物料守恒,在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO![]() ),故C错误;CO
),故C错误;CO![]() 水解促进NH水解,所以c(NH)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,c[(NH4)2SO4]<c[(NH4)2CO3]< c(NH4Cl),故D错误。
水解促进NH水解,所以c(NH)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,c[(NH4)2SO4]<c[(NH4)2CO3]< c(NH4Cl),故D错误。


科目:高中化学 来源: 题型:
【题目】铁铝化合物在生活生产中有广泛应用。
(1)自然界中存在的54Fe和56Fe,它们互称为_____。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因_____。
(3)已知明矾可以净水,明矾化学式_____,试结合离子反应方程式与文字解释明矾净水的原因_____
(4)以NaAlO2溶液、AlCl3溶液、氨水、CO2气体为原料,选择合适试剂,写出实验室制备Al(OH)3的离 子方程式:(任意两条途径)_____、_____
(5)达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐,化学式为Al2Mg6(OH)16CO3·4H2O【可看做2Al(OH)3·5Mg(OH)2·MgCO3·4H2O】。1mol达喜分别与足量的盐酸和 NaOH 溶液反应,消耗盐酸和 NaOH 的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体加热到850℃时,可建立下列平衡:CO2+H2![]() CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
CO+H2O(g),在一定温度下,平衡时有90% H2变成水,且平衡常数K=1,则原混合气体中CO2与H2的分子数比为( )
A. 1︰1 B. 1︰5 C. 1︰10 D. 9︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1![]()
![]() 溶液:
溶液:![]()
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
A. 1.0×10-2molL-1 B. 1.0×10-7molL-1
C. 1.0×10-12molL-1 D. 1.0×10-14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。
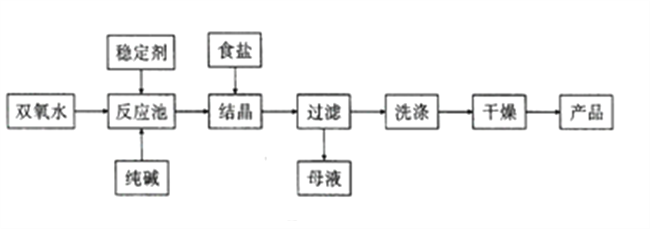
(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g) ![]() HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2![]() C6H12(环已烷);C6H5-CH3(甲苯)+3H2
C6H12(环已烷);C6H5-CH3(甲苯)+3H2![]() C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________;
②能体现环已烷分子的空间构型的键线式为____________。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2![]() TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________。
②基态钛原子中电子能量最高的电子排布图为_________
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏加德罗常数的值,则该晶体的密度为_______g·cm-3。
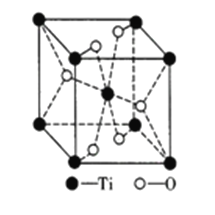
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应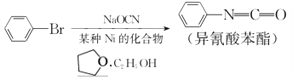 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com