
【题目】以废旧铅蓄电池的含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯PbO,实现铅的再生利用。其主要流程如下:
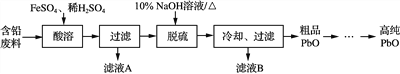
(1) 酸溶过程中加热的目的是______________。酸溶时,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是________________________。
(2) 检验滤液A中是否含有Fe2+,可选用下列________试剂(选填序号)。
a. KSCN溶液 b. 氯水 c. 酸性KMnO4溶液
(3) 写出脱硫过程发生主要反应的离子方程式__________________。
(4) 冷却过滤后对所得的固体进行洗涤的操作________________。
(5) PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)
NaHPbO2(aq)
其溶解度曲线如图所示。结合上述溶解度曲线,简述由粗品PbO得到高纯PbO的操作____________。
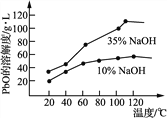
【答案】 加快酸溶速率 Pb+PbO2+2H2SO4=2PbSO4+2H2O c PbSO4+2OH-=PbO+SO42-+H2O 沿玻璃棒向过滤器(漏斗)中加入蒸馏水至浸没沉淀,待水慢慢流出,重复2~3次 将粗PbO溶解在一定量35% NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体
【解析】(1)酸溶过程中加热的目的是加快酸溶速率。酸溶时,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是Pb+PbO2+2H2SO4=2PbSO4+2H2O。(2)亚铁离子具有还原性,检验滤液A中是否含有Fe2+,可选用酸性KMnO4溶液,答案选c;(3)脱硫过程中硫酸铅和氢氧化钠溶液反应,因此发生主要反应的离子方程式为PbSO4+2OH-=PbO+SO42-+H2O。(4)洗涤沉淀在过滤器中进行,实验操作是沿玻璃棒向过滤器(漏斗)中加入蒸馏水至浸没沉淀,待水慢慢流出,重复2~3次。(5) 根据图像可知35% NaOH溶液的溶解度受温度影响较大,超过110℃随温度升高而降低,因此由粗品PbO得到高纯PbO的操作为将粗PbO溶解在一定量35% NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上________(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为______,正极的电极反应式为___________。
(2)如果烧杯中最初装入的是500mL2molL-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
(2)A中的碳原子是否都处于同一平面? (填“是”或“不是”);
(3)已知A、B、C有如下转化关系:

则反应②的化学方程式为 ;C的化学名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中三元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是
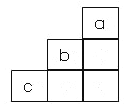
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合物为+7价。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法中正确的是
A. 自然界中不存在游离态的硫B. SO2和SO3的水溶液都是强酸
C. 二氧化硫能使品红溶液褪色D. 浓硫酸可用来干燥NH3等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com