
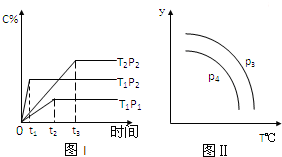
| A. | 若P3>P4,则y轴表示B的百分含量 | |
| B. | 若P3>P4,则y轴表示混合气体的平均摩尔质量 | |
| C. | 若P3<P4,则y轴表示B的体积分数 | |
| D. | 若P3<P4,则y轴表示混合气体的密度 |
分析 由图1可知,温度T1时,P2到达平衡的时间短,则反应速率快,所以P2>P1,压强越大,C%越大,则正反应方向为体积减小的方向,所以x=1;压强P2时,T1到达平衡的时间短,则反应速率快,所以T1>T2,温度越高,C%越小,故正反应为放热反应;由图Ⅱ可知,Y随温度的升高而降低,根据选项结合压强对平衡移动的影响判断P3、P4的关系.
解答 解:由图1可知,温度T1时,P2到达平衡的时间短,则反应速率快,所以P2>P1,压强越大,C%越大,则正反应方向为体积减小的方向,所以x=1;压强P2时,T1到达平衡的时间短,则反应速率快,所以T1>T2,温度越高,C%越小,故正反应为放热反应,
A.升高温度平衡向逆反应方向移动,B的质量分数增大,增大压强平衡向正反应方向移动,B的百分含量减小,则P3<P4,故A错误;
B.升高温度平衡向逆反应方向移动,C的体积减小,增大压强平衡向正反应方向移动,C的质量分数增大,则P3>P4,故B正确;
C.混合气体总质量不变,升高温度平衡向逆反应方向移动,混合气体总物质的量增大,平均相对分子质量减小,增大压强平衡向正反应方向移动,混合气体总物质的量减小,混合气体平均相对分子质量增大,则P3>P4,故C错误;
D.混合气体总质量不变,容器容积不变,反应混合气体的密度不变,故D错误,
故选B.
点评 本题考查化学平衡图象、影响化学平衡的因素,关键是利用“定一议二”与“先拐先平数值大”原则分析反应特征.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2克氢气所含原子数目为NA | |
| B. | 在标准状况下,O2和H2混合气体1mol所占的体积约为22.4 L | |
| C. | 在常温常压下,22.4LH2O所含的原子数目为3NA | |
| D. | 4.6克钠与水反应时失去的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子的空间构型为直线形 | |
| B. | CO2分子为非极性分子 | |
| C. | BF3分子中的B原子满足8电子稳定结构 | |
| D. | CH3COOH分子中C原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、ClO-、CO3- | B. | NH4+、K+、OH-、NO3- | ||
| C. | H+、Mg2+、MnO4-、SO42- | D. | Fe3+、Na+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 离子组 | 要求 |
| A | K+、CO32-、SO42-、Cl- | c(K+)<c(Cl-) |
| B | Na+、CO32-、NO3-、I- | 滴加盐酸立刻有气体生成 |
| C | Mg2+、Cl-、Na+、SO42- | 滴加氨水立刻有沉淀生成 |
| D | NH4+、SO42-、Na+、H+ | 滴加烧碱溶液立刻有气体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、玻璃棒、胶头滴管 | FeCl3溶液、NaOH溶液 | 制Fe(OH)3胶体 |
| B | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的二氧化碳、蒸馏水 | 模拟喷泉实验 |
| C | 酸式滴定管、锥形瓶、铁架台(带铁夹) | 已知浓度的盐酸,待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、蒸发皿、三脚架 | NaCl溶液 | 蒸发溶液得到晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com