
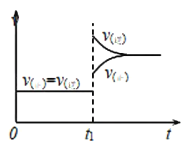
【题目】对于反应![]() ,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,
,减小压强,平衡向______(填“正反应”或“逆反应”)方向移动,平衡混合气体的平均相对分子质量在平衡移动时______(填“是”或“否”)发生改变,其原因是____________;下图是反应速率与时间的关系图,![]() 时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
时刻引起正、逆反应速率变化的原因可能是____________(写一条合理原因)。
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
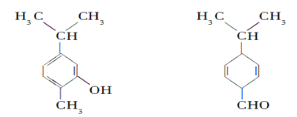
A. 不是同分异构体B. 分子中共平面的碳原子数相同
C. 均能与溴水发生加成反应D. 可用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是___,被氧化的元素是___。
(2)配平以下方程式:___K2Cr2O7+___HCl═___KCl+___CrCl3+___Cl2↑+___H2O
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3![]() 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的物质的量为___mol;标准状况下,产生NO气体的体积为___mL。
②反应后,NO3-的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼美舒利是一种非甾体抗炎药,它的一种的合成路线如下:
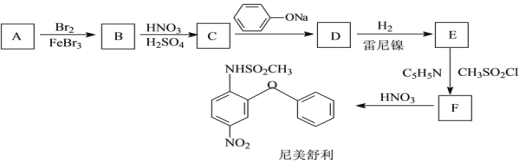
已知:![]() (易氧化)
(易氧化)
![]()
回答下列问题:
(1)B的结构简式为____,由C生成D的化学方程式为_______;
(2)E的同分异构体中能同时满足下列条件的共有___种(不含立体异构),
①含有两个苯环且两个苯环直接相连;
②能与FeCl3溶液发生显色反应;
③两个取代基不在同一苯环上。
其中核磁共振氢谱为6组峰,峰面积比为2∶2∶2∶2∶2∶1的结构简式为_____。
(3)由甲苯为原料可经三步合成2,4,6-三氨基苯甲酸,合成路线如下:

反应①的试剂和条件为______;中间体B的结构简式为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产自来水最重要的两步工序是净化和消毒,净化一般使用![]() ,消毒一般使用
,消毒一般使用![]() 。
。
(1)![]() 溶液呈酸性的原因是(用离子方程式表示)____________;
溶液呈酸性的原因是(用离子方程式表示)____________;![]() 具有净水作用,但会腐蚀钢铁设备,除
具有净水作用,但会腐蚀钢铁设备,除![]() 作用外,另一主要原因是(用离子方程式表示):____________。
作用外,另一主要原因是(用离子方程式表示):____________。
(2)氯气的水溶液称为氯水,氯水中存在多个平衡,写出其中两个含氯元素的平衡方程式:____________、____________。氯水中存在![]() 分子、
分子、![]() 分子和
分子和![]() 分子,不存在
分子,不存在![]() 分子的原因是_______,除水分子外,新制氯水中含量最多的微粒是__________。
分子的原因是_______,除水分子外,新制氯水中含量最多的微粒是__________。
(3)次氯酸有漂白杀菌作用,其作用原理是![]() ,该变化是____________反应(选填“氧化”、“还原”、“氧化还原”);在
,该变化是____________反应(选填“氧化”、“还原”、“氧化还原”);在![]() 溶液中通入少量
溶液中通入少量![]() 气体,只发生如下反应:
气体,只发生如下反应:![]() ,由此判断
,由此判断![]() 、
、![]() 和
和![]() 的酸性由强到弱的顺序是____________。
的酸性由强到弱的顺序是____________。
(4)![]() 能用于自来水消毒,还能除去水中的
能用于自来水消毒,还能除去水中的![]() 杂质,产物为
杂质,产物为![]() 和盐酸。写出该反应的离子方程式__________________。
和盐酸。写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品具有耗电量低、寿命长的特点。下图是氢氧燃料电池驱动LED屏发光的装置,下列有关叙述错误的是( )
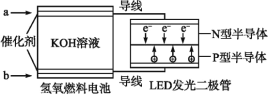
A.a处通入的气体是氢气,电极反应式为H2+2OH-2e=2H2O
B.装置中电子的流向为a极→N型半导体→P型半导体→b极
C.装置中的能量转化至少涉及三种形式的能量
D.图中![]() 表示来自氢氧燃料电池中的K+的移动方向
表示来自氢氧燃料电池中的K+的移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
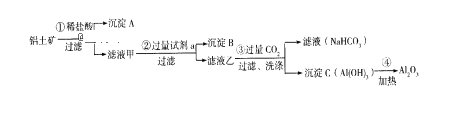
①沉淀A、B的成分分别是______、______;步骤②中的试剂a是_____;(以上均填化学式)。
②试写出步骤③中生成沉淀C的离子方程式________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:______________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2xH2O)。有如下操作:
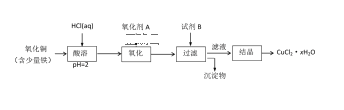
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①试剂B可选用______(填编号)。
A.NaOH溶液 B.CuO C.浓氨水 D.Cu2(OH)2CO3
②若氧化剂A是H2O2溶液,写出加入氧化剂A发生反应的离子方程式________
③从滤液经过结晶得到氯化铜晶体的方法是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com