
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
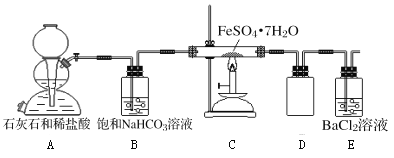
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。
【答案】+2价 褪色 +3价 血红色 赶走装置内的空气 除去CO2中的HCl HCO3-+H2O![]() H2CO3+OH- FeSO47H2O
H2CO3+OH- FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O 未进行尾气处理
Fe2O3+SO2↑+SO3↑+14H2O 未进行尾气处理
【解析】
实验一,Fe元素有+2价、+3价,所以产物可能为Fe2(SO4)3、FeSO4或Fe2(SO4)3和FeSO4的混合物,铁元素化合价可能是+2价,+3价,或+2,+3价;①向所得溶液中滴入KSCN溶液;②向稀酸性KMnO4溶液中滴入所得溶液.KSCN溶液无明显现象,稀酸性KMnO4溶液颜色褪去,证明只含有Fe2+;稀酸性KMnO4溶液颜色无变化,证明一定是+3价铁元素;若KSCN溶液出现血红色现象,稀酸性KMnO4溶液颜色褪去,证明Fe元素既有+2价又有+3价;所以答案为+2价,褪色,+3价,血红色
实验二:(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,目的是赶走装置内的空气,避免影响测定结果;
(2)由石灰石和盐酸反应制取的CO2气体中有HCl杂质,必须除去,所以饱和碳酸氢钠溶液的作用是除去CO2中的HCl;NaHCO3溶液是弱酸的酸式盐,HCO3-的水解程度大于其电离程度,导致其溶液呈碱性,用离子方程式表示为HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)55.6克绿矾FeSO47H2O的物质的量是0.2摩尔,其中A中产生的二氧化碳是不会和氯化钡反应生成沉淀的,二氧化硫也不和氯化钡产生沉淀;所以,产生的沉淀就只能是硫酸钡,也就是说,一定会有三氧化硫产生,根据沉淀的质量是23.3克,所以硫酸钡的物质的量是0.1摩尔,所以产生的三氧化硫是0.1摩尔,根据原子守恒,在绿矾中的硫是0.2摩尔,剩余的0.1摩尔的硫可能有很多的生成形式,可能是单质硫,也可以使其他形态的硫,但是C瓶中并没有单质硫析出;不管是那种形态的硫存在,硫元素化合价一定降低了,所以铁元素化合价一定要升高,根据电子守恒计算,0.2molFe2+变化为Fe3+;硫元素化合价从+6价变化为x价,0.2×1=0.1×(6-x),x=+4,所以实验生成的产物中有SO2,依据原子守恒配平书写化学方程式为FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O;
Fe2O3+SO2↑+SO3↑+14H2O;
(4)分析装置生成的气体中二氧化硫有毒不能排放到空气中需要尾气吸收;则答案为未进行尾气吸收;


科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
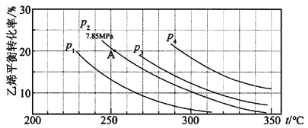
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25 ℃水的电离常数是1.0×10-12
B.中性溶液的c(H+)=![]()
C.纯水在100 ℃时,c(H+)>10-7 mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
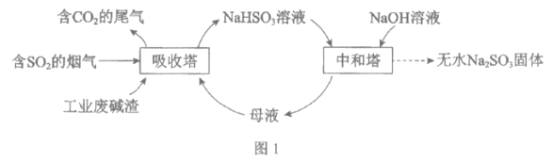
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
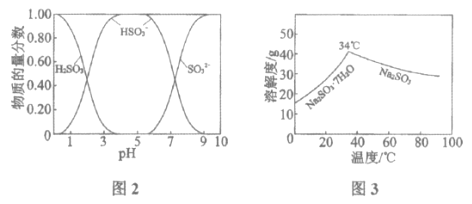
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阳极区,在氢化酶作用下发生反应H2+2MV2+=2H++2MV+
C.正极区,在固氮酶催化作用下发生反应N2+6MV++6H2O=2NH3+6MV2++6OH-
D.电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 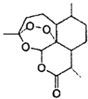 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com