
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
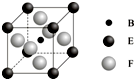 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、四种溶液中,Na2CO3溶液中水的电离程度最大 |
| B、NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32- |
| C、向氯水中加入少量NaHCO3(s),可以增大氯水中次氯酸的浓度 |
| D、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 |
| B、电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 |
| C、电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 |
| D、铜锌原电池中,锌作负极,电子从锌极流向铜极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
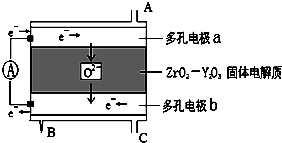
| A、多孔电极a是燃料电池的负极 |
| B、生成的水从B口流出,汽油从C口流入 |
| C、在固体电解质中,O2-由正极移向负极 |
| D、通入汽油的一极是负极,电极反应为:C2H6+7O2--14e-═2CO2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、可能含有的离子是①②⑦ |
| B、肯定含有的离子是①④ |
| C、不能确定的离子是①③⑦ |
| D、肯定没有的离子是②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com