


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省乐山市高三第二次调查研究考试理科综合试卷(化学部分) 题型:选择题
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
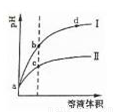
A.曲线Ⅰ为醋酸稀释时溶液pH变化曲线
B.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
C.a点时,加入少量相同大小的锌粒,与盐酸反应的速率大
D.b点溶液中水的电离程度比c点溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:单选题

查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
A.曲线Ⅰ为醋酸稀释时溶液pH变化曲线
B.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
C.a点时,加入少量相同大小的锌粒,与盐酸反应的速率大
D.b点溶液中水的电离程度比c点溶液中水的电离程度大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com