

分析 Zn与硫酸能发生自发的氧化还原反应,所以烧杯I中构成原电池,Zn失电子为负极,Cu上氢离子得电子,Cu为正极,烧杯II中Cu与正极相连为阳极,C与负极相连为阴极,结合两极上发生的反应分析.
解答 解:(1)Zn与硫酸能发生自发的氧化还原反应,所以烧杯I中构成原电池,Zn失电子为负极,Cu上氢离子得电子,Cu为正极,烧杯II有外接电源为电解池;
故答案为:原电;电解;
(2)Zn失电子为负极,Cu上氢离子得电子,Cu为正极,烧杯II中Cu与正极相连为阳极;
故答案为:正;阳;
(3)烧杯I中发生反应为Zn+H2SO4=ZnSO4+H2 ↑;
故答案为:Zn+H2SO4=ZnSO4+H2 ↑;
(4)烧杯I中负极锌逐渐溶解,正极上氢离子得电子生成氢气,烧杯II中阳极上Cu失电子生成铜离子,阴极上氢离子得电子生成氢气,同时溶液中生成氢氧根离子,氢氧根离子与铜离子结合形成氢氧化铜蓝色沉淀;
故答案为:烧杯I锌逐渐溶解,铜上有气泡;烧杯II中Cu逐渐溶解,C上有气泡,溶液中生成蓝色沉淀;
(5)当锌片溶解6.5g时,即消耗Zn为0.1mol,转移电子为0.2mol,则铜上生成的氢气为0.1mol,在标准状况下体积为2.24L;
故答案为:2.24.
点评 本题考查原电池原理和电解池原理,侧重于学生的分析、计算能力的考查,明确正负极和阴阳极上发生的反应是解本题关键,题目难度不大.


科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
右图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为
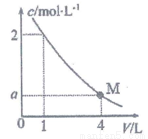
A. 0.25mol/L B. 0.5mol/L C.1 mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液中无OH- | |
| B. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=10-14 | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 氢氧化钠溶液中无H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 能形成+7价含氧酸及其盐的元素一定属于主族元素 | |
| D. | 原子最外层电子数等于6的元素一定属于主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
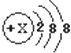
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol•L-1NaOH溶液中Na+的数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com