
【题目】可逆反应A(g)+3B(g)![]() C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.2mol/(Ls)B.v(B)=0.6mol/(Ls)
C.v(C)=0.3mol/(Ls)D.v(D)=0.5mol/(Ls)
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
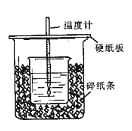
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸乙酯与NaOH溶液在加热条件下发生水解,生成醋酸钠和乙醇。而1mol![]() 与NaOH溶液发生反应时最多消耗3 mol NaOH。五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
与NaOH溶液发生反应时最多消耗3 mol NaOH。五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
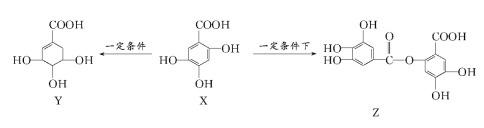
下列说法错误的是( )
A. 1molZ最多能与6molNaOH发生反应
B. 1molX最多能与2molBr2发生取代反应
C. Y分子结构中有2个手性碳原子
D. Y能发生加成、取代、消去、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
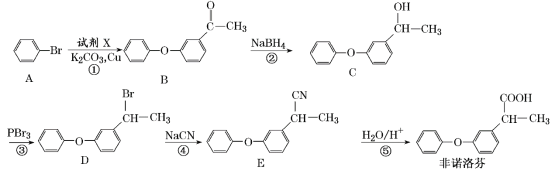
请回答下列问题:
(1)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为_______。
(2)中间产物C、D可以发生相同的反应类型生成相同的物质F,F具有能发生加聚反应的常见官能团,则该反应的反应类型是______;C→F的反应条件是________;D→F的反应条件是______。
(3)根据相关信息并结合已有知识,写出以![]() 为原料制备
为原料制备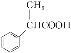 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3_______
CH3COOCH2CH3_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)=2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)=2Al(l)+AlCl3(g);ΔH3
试比较a、b的大小,并说明理由:a___b,理由是___。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
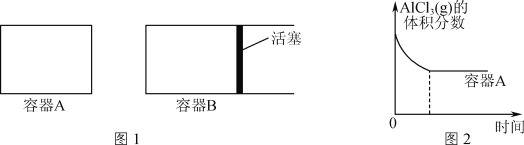
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1molAlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。___
②1100℃时,向2L密闭容器中通入3molAlCl(g),发生反应:3AlCl(g)![]() 2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=___。
2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=___。
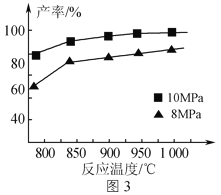
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是___。研究表明,当温度达到2500℃以上时,图中曲线重合,试分析可能原因___。
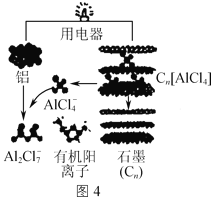
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。该电池充电时,阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是
A | B | C | D |
|
|
|
|
制取Cl2 | 使Br-转化为Br2 | 分离出溴的苯溶液 | 将分液后的水层蒸干获得无水FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验如果设计或操作不当,可能看不到预期的现象。下列关于实验现象的分析不正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
现象 | 量筒中未出现油状液体 | 试管中有黑色沉淀,但未出现银镜 | 试管中未看到白色沉淀 | NaOH溶液液面上 未看到油状液体 |
原因 | 甲烷与氯气未反应 | 反应未生成单质银 | 苯酚浓度 较大 | 产物水解 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧电路板为原料制备硫酸铜可以变废为宝。下图是某科研小组设计的工艺流程(流程中 RH 为萃取剂),下列说法不正确的是

A.“粉碎”可以增大反应的接触面积,提高浸取速率和铜的浸取率
B.“浸取”发生的离子反应为 Cu+H2O2+2NH3 +2NH4+=Cu(NH3)42++2H2O
C.工艺流程中循环使用的物质有 NH3、NH4Cl、RH 和有机溶剂
D.从硫酸铜溶液获得纯净的硫酸铜晶体的操作是:加入适量乙醇,蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
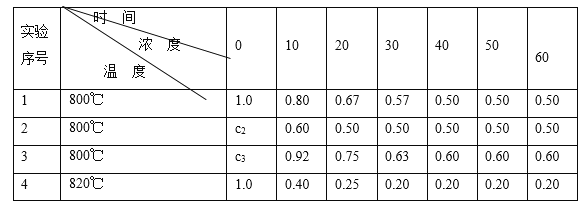
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com