
【题目】氮的化合物在工业生产中有广泛的用途
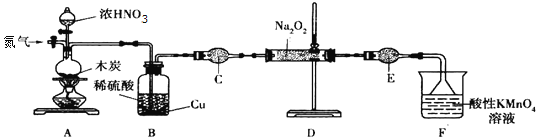
Ⅰ![]() 实验室可用如下装置
实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制备亚硝酸钠。
制备亚硝酸钠。
已知:①![]() ;
;
②酸性条件下,NO和![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]() ;
;![]() 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间![]() ,目的是_______________________。
,目的是_______________________。
(2)装置A中发生反应的化学方程式为_______。酸性![]() 溶液的作用是_______。
溶液的作用是_______。
(3)仪器C的名称为______________,其中盛放的药品为 ____________![]() 填名称
填名称![]() 。
。
Ⅱ![]() 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
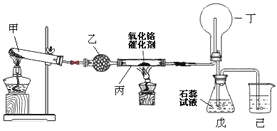
(1)已知甲装置试管中的固体是碳酸铵![]() 晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
(2)写出受热时丙装置发生反应的化学方程式为________________。
(3)当戊中观察到____________________________现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因:______________________。如何改进装置?_______。
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是____。
【答案】排除装置内的空气 ![]() 尾气吸收,防止污染空气 干燥管 碱石灰
尾气吸收,防止污染空气 干燥管 碱石灰 ![]() 吸收二氧化碳,产生氧气 4NH3+5O2
吸收二氧化碳,产生氧气 4NH3+5O2![]() 4N0+6H2O 紫色石蕊试液变红 过量的氨气致使戊中溶液不一定呈酸性 在丙和丁之间连接盛有浓硫酸的洗气瓶 装置丁内水面慢慢上升,上升到一定高度不再变化,装置丁内气体颜色由红棕色逐渐变淡至无色
4N0+6H2O 紫色石蕊试液变红 过量的氨气致使戊中溶液不一定呈酸性 在丙和丁之间连接盛有浓硫酸的洗气瓶 装置丁内水面慢慢上升,上升到一定高度不再变化,装置丁内气体颜色由红棕色逐渐变淡至无色
【解析】
Ⅰ![]() 分析题给装置和实验原理知装置中空气中的氧气对实验产生干扰,据此解答;
分析题给装置和实验原理知装置中空气中的氧气对实验产生干扰,据此解答;
![]() 装置A中浓硝酸在加热条件下与木炭反应生成二氧化氮、二氧化碳和水,酸性
装置A中浓硝酸在加热条件下与木炭反应生成二氧化氮、二氧化碳和水,酸性![]() 溶液的作用是尾气吸收,防止污染空气,据此解答;
溶液的作用是尾气吸收,防止污染空气,据此解答;
![]() 根据仪器C构造特点判断其名称为干燥管,作用是吸收一氧化氮中的二氧化碳和水蒸气,其中盛放的药品为碱石灰,据此解答;
根据仪器C构造特点判断其名称为干燥管,作用是吸收一氧化氮中的二氧化碳和水蒸气,其中盛放的药品为碱石灰,据此解答;
Ⅱ![]() 乙装置中的固体是过氧化钠,乙装置的作用是吸收二氧化碳,产生氧气,据此解答;
乙装置中的固体是过氧化钠,乙装置的作用是吸收二氧化碳,产生氧气,据此解答;
![]() 氨气和氧气的混合气体在丙中催化剂、加热的条件下发生氨的催化氧化,据此解答;
氨气和氧气的混合气体在丙中催化剂、加热的条件下发生氨的催化氧化,据此解答;
![]() 丁装置中发生反应:
丁装置中发生反应:![]() ,戊装置中发生反应:
,戊装置中发生反应:![]() ,硝酸可以使紫色石蕊试液变红;由于反应时氨气和氧气的量不能准确控制,若氨气过量,氨气与硝酸反应生成盐,可能导致戊装置中溶液不显酸性,无法观察到紫色石蕊试液变红的现象,改进措施是在丙和丁之间加一个装置除去氨气,据此解答;
,硝酸可以使紫色石蕊试液变红;由于反应时氨气和氧气的量不能准确控制,若氨气过量,氨气与硝酸反应生成盐,可能导致戊装置中溶液不显酸性,无法观察到紫色石蕊试液变红的现象,改进措施是在丙和丁之间加一个装置除去氨气,据此解答;
![]() 改进后丁装置中气体为
改进后丁装置中气体为![]() 和
和![]() 的混合气体,将丁倒立于盛水的水槽中,红棕色的
的混合气体,将丁倒立于盛水的水槽中,红棕色的![]() 气体溶于水,无色气体NO难溶于水,据此解答。
气体溶于水,无色气体NO难溶于水,据此解答。
Ⅰ![]() 分析题给装置和实验原理知装置中空气中的氧气对实验产生干扰,故加热装置A前,先通一段时间
分析题给装置和实验原理知装置中空气中的氧气对实验产生干扰,故加热装置A前,先通一段时间![]() ,目的是排除装置内的空气,故答案为:排除装置内的空气;
,目的是排除装置内的空气,故答案为:排除装置内的空气;
![]() 装置A中浓硝酸在加热条件下与木炭反应生成二氧化氮、二氧化碳和水,发生反应的化学方程式为
装置A中浓硝酸在加热条件下与木炭反应生成二氧化氮、二氧化碳和水,发生反应的化学方程式为![]() 。酸性
。酸性![]() 溶液的作用是尾气吸收,防止污染空气,故答案为:
溶液的作用是尾气吸收,防止污染空气,故答案为:![]() ;尾气吸收,防止污染空气;
;尾气吸收,防止污染空气;
![]() 根据仪器C构造特点判断其名称为干燥管,作用是吸收一氧化氮中的二氧化碳和水蒸气,其中盛放的药品为碱石灰,故答案为:干燥管;碱石灰;
根据仪器C构造特点判断其名称为干燥管,作用是吸收一氧化氮中的二氧化碳和水蒸气,其中盛放的药品为碱石灰,故答案为:干燥管;碱石灰;
Ⅱ![]() 乙装置中的固体是过氧化钠,乙装置的作用是吸收二氧化碳,产生氧气,故答案为:
乙装置中的固体是过氧化钠,乙装置的作用是吸收二氧化碳,产生氧气,故答案为:![]() ;吸收二氧化碳,产生氧气;
;吸收二氧化碳,产生氧气;
![]() 氨气和氧气的混合气体在丙中催化剂、加热的条件下发生反应的化学方程式:
氨气和氧气的混合气体在丙中催化剂、加热的条件下发生反应的化学方程式: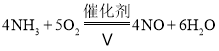 ,故答案为:
,故答案为: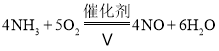 ;
;
![]() 丁装置中发生反应:
丁装置中发生反应:![]() ,戊装置中发生反应:
,戊装置中发生反应:![]() ,硝酸可以使紫色石蕊试液变红;由于反应时氨气和氧气的量不能准确控制,若氨气过量,氨气与硝酸反应生成盐,可能导致戊装置中溶液不显酸性,无法观察到紫色石蕊试液变红的现象;改进措施是在丙和丁之间加一个盛有无水氯化钙的干燥管
,硝酸可以使紫色石蕊试液变红;由于反应时氨气和氧气的量不能准确控制,若氨气过量,氨气与硝酸反应生成盐,可能导致戊装置中溶液不显酸性,无法观察到紫色石蕊试液变红的现象;改进措施是在丙和丁之间加一个盛有无水氯化钙的干燥管![]() 氯化钙可以与氨气反应生成
氯化钙可以与氨气反应生成![]()
![]() ,或者盛有浓硫酸的洗气瓶,通过该装置除去氨气,故答案为:紫色石蕊试液变红;过量的氨气致使戊中溶液不一定呈酸性;在丙和丁之间连接盛有浓硫酸的洗气瓶;
,或者盛有浓硫酸的洗气瓶,通过该装置除去氨气,故答案为:紫色石蕊试液变红;过量的氨气致使戊中溶液不一定呈酸性;在丙和丁之间连接盛有浓硫酸的洗气瓶;
![]() 改进后丁装置中气体为
改进后丁装置中气体为![]() 和
和![]() 的混合气体,将丁倒立于盛水的水槽中,红棕色的
的混合气体,将丁倒立于盛水的水槽中,红棕色的![]() 气体溶于水:
气体溶于水:![]() ,无色气体NO难溶于水,因此现象为装置丁内水面慢慢上升,上升到一定高度不再变化,装置丁内气体颜色由红棕色逐渐变淡至无色,故答案为:装置丁内水面慢慢上升,上升到一定高度不再变化,装置内气体颜色由红棕色逐渐变淡至无色。
,无色气体NO难溶于水,因此现象为装置丁内水面慢慢上升,上升到一定高度不再变化,装置丁内气体颜色由红棕色逐渐变淡至无色,故答案为:装置丁内水面慢慢上升,上升到一定高度不再变化,装置内气体颜色由红棕色逐渐变淡至无色。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】最近意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知Ⅰ、断裂1 mol N—N吸收167 kJ热量,形成1 mol ![]() 放出942 kJ热量;Ⅱ、N2(g)+3H2(g)
放出942 kJ热量;Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)
2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)![]() 4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
A.ΔH2>0B.N2分子比N4分子稳定
C.ΔH2=2ΔH1D.ΔH2与方程式系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷As是第四周期ⅤA族元素,可以形成 As2S3、As2O5、H3AsO3、H3AsO4等 化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣主要成分为As2S3制成浆状,通入O2氧化,生成H3AsO4和单质硫,写出发生反应的化学方程式___________;该反应需要在加压下进行,原因是___________.
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H =___________
(4)298K时,将20mL 3x molL-1 Na3AsO3、20mL 3x molL-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
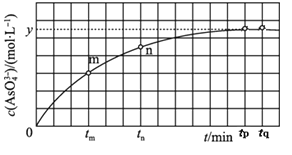
①下列可判断反应达到平衡的是 ______ 填标号.
a .溶液的pH不再变化 b. v(I-)=2v(AsO33-)
c .c (AsO43-)/c (AsO33-)不再变化 d. c(I-)=ymolL-1
②tm时v正_____v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v正(填“大于”“小于”或“等于”)理由是 _____
④若平衡时溶液c(OH-)=1 mol/L,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制取乙酸乙酯的装置。
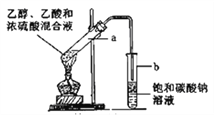
请回答:
(1)检验该装置气密性的方法是_________________________________。
(2)浓硫酸的作用是__________________。
(3)下列有关该实验的说法中,正确的是________。
A.向a试管中加入沸石,其作用是防止加热时液体爆沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH和CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体PCl5受热即挥发并发生分解:PCl5(g)![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟工业上以预处理后的铬铁矿粉![]() 主要成分
主要成分![]() ,含少量
,含少量![]() 为原料制备
为原料制备![]() 并测定纯度,设计如下实验。回答下列问题:
并测定纯度,设计如下实验。回答下列问题:
Ⅰ![]() 煅烧铬铁矿粉。
煅烧铬铁矿粉。
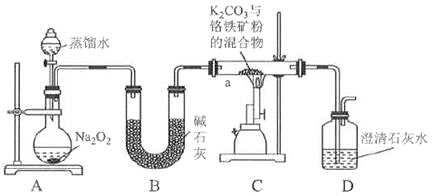
已知:煅烧时,![]() 转化为
转化为![]() 。
。
(1)盛放![]() 的仪器名称为________装置B的作用为________。
的仪器名称为________装置B的作用为________。
(2)![]() 不能选用玻璃容器的原因为________。
不能选用玻璃容器的原因为________。
(3)实验时,a中所得产物除![]() 外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
Ⅱ![]() 制备
制备![]() 。
。
(4)实验结束后,冷却至室温。取a中固体加水溶解,调节溶液的pH为![]() ;过滤,调节滤液的
;过滤,调节滤液的![]() ,蒸发浓缩、降温结晶,过滤、洗涤,得
,蒸发浓缩、降温结晶,过滤、洗涤,得![]() 粗品。
粗品。
①调节溶液的pH为![]() 后,第一次过滤,所得沉淀的成分为________
后,第一次过滤,所得沉淀的成分为________![]() 填化学式
填化学式![]() 。
。
②过滤所用主要玻璃仪器有________。
③结合离子方程式说明调节滤液的![]() 的目的为________。
的目的为________。
Ⅲ![]() 测定粗品中
测定粗品中![]() 的质量分数。
的质量分数。
(5)称取![]() 粗品,溶于适量水,酸化后配成100mL溶液;取
粗品,溶于适量水,酸化后配成100mL溶液;取![]() 所配溶液,滴加几滴指示剂,用
所配溶液,滴加几滴指示剂,用![]() 标准
标准![]() 溶液滴定至终点
溶液滴定至终点![]() 杂质不参加反应,还原产物为
杂质不参加反应,还原产物为![]() ,消耗标准液的体积为VmL。粗品中
,消耗标准液的体积为VmL。粗品中![]() 的质量分数为___
的质量分数为___![]() 用含c、m、V的代数式表示
用含c、m、V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 两种溶液,选择填空:
两种溶液,选择填空:
A. ![]()
(1)当它们pH相同时,其物质的量浓度______.
(2)当它们的物质的量浓度相同时,其pH的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______.
(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(6)将pH相同的两种酸均稀释10倍后,pH关系为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
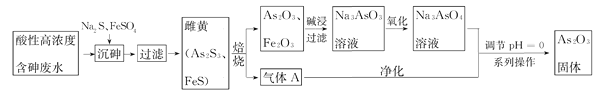
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com