
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
分析 A.蒸发时不能蒸干,利用余热加热;
B.蒸馏时,温度计测定馏分的温度;
C.萃取时,有机溶剂与水分层,与密度无关;
D.分液时避免上下层液体混合.
解答 解:A.蒸发时不能蒸干,利用余热加热,则边加热边用玻璃棒搅拌,出现大量固体时停止加热,故A错误;
B.蒸馏时,温度计测定馏分的温度,则温度计的水银球在支管口处,故B错误;
C.萃取时,有机溶剂与水分层,与密度无关,且不发生反应,溶质在不同溶剂中的溶解性差异较大,故C错误;
D.分液时避免上下层液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
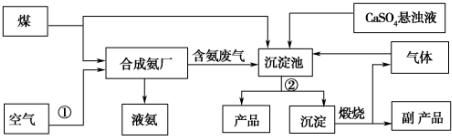
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
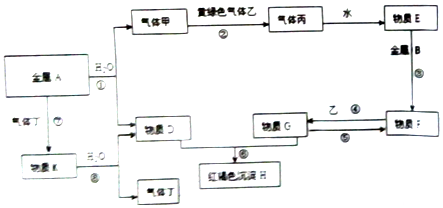
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 钢管与铜管露天堆放在一起时,钢管不易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应式:2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
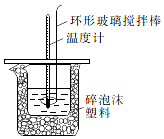 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
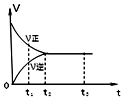
| A. | t1时,只有正方向反应 | |
| B. | t2-t3,反应不再发生 | |
| C. | t2-t3,各物质的浓度均没有发生变化 | |
| D. | t2时,反应到达限度,正反应和逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶和滴定管都需要用试剂润洗 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用滴定管准确量取20.0 mL盐酸 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
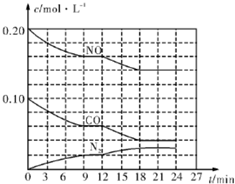 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com