
| A. | CH3CHO | B. | CH2═CHCOOH | C. | CH3CH2OH | D. | CH2═CHCHO |
分析 有机物燃烧时,生成等物质的量的CO2和H2O,可知有机物中C、H原子个数比为1:2;该有机物还能与新制Cu(OH)2悬浊液反应,则有机物含-CHO或-COOH,以此来解答.
解答 解:A.CH3CHO中C、H原子个数比为1:2,含-CHO,符合题意,故A选;
B.CH2═CHCOOH中C、H原子个数比为3:4,不符合题意,故B不选;
C.CH3CH2OH中C、H原子个数比为1:3,且不含-CHO、-COOH,不符合题意,故C不选;
D.CH2═CHCHO中C、H原子个数比为3:4,不符合题意,故D不选;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、官能团与性质为解答的关键,侧重分析与应用能力的考查,注意醛和羧酸的性质,题目难度不大.


科目:高中化学 来源: 题型:实验题
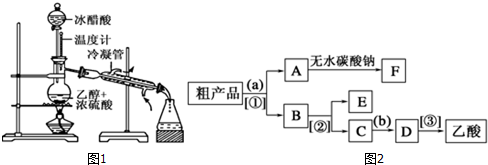
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低体系温度能加快该反应的速率 | |
| B. | 0~2S内用O2表示该反应的平均反应速率为0.15mol/(L•s) | |
| C. | 增大SO3的浓度能减慢该反应速率 | |
| D. | 反应一段时间后可生成4molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
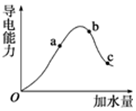 一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NH3、蔗糖分别属于强电解质、弱电解质、非电解质 | |
| B. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| C. | H2SO3(aq)+2NaOH(aq)=Na2SO3(aq)+2H2O(l)△H>-114.6 kJ/mol | |
| D. | 由石墨比金刚石稳定可推知:C(石墨)═C(金刚石)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
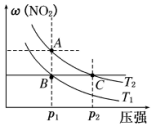 反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )
反应 N2O4(g)?2NO2(g)在温度为 T1、T2(T2>T1)时,平衡体系中 NO2的体积分数随压强变化如图所示.下列说法正 确的是( )| A. | 由图可知 B 点的平衡常数大于 C 点的平衡常数 | |
| B. | A、C 两点气体的颜色:A 深,C 浅 | |
| C. | A、C 两点气体的平均相对分子质量:A<C | |
| D. | 保持容器体积不变,再充入 N2O4 气体,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | CO2通入石灰乳中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 铁屑溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com