
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视。
I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
___  C+ ___ KMnO4 + 6 H2SO4→____CO
C+ ___ KMnO4 + 6 H2SO4→____CO 2↑+ ____MnSO4 + ____K2SO4 + 6 H2
2↑+ ____MnSO4 + ____K2SO4 + 6 H2 O
O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2 L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,得到如下数据:
CO2(g)+H2(g) △H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
(1)实验I中,前5min的反应速率υ(CO2)= mol•L1•min1。
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是 。
A.容器内压强不再变化 B.
 C.混合气体密度不变 D.υ正(CO) =
C.混合气体密度不变 D.υ正(CO) = υ逆(CO2)
υ逆(CO2)
(3)实验III中:y= 。
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验
测得H2O(g)的转化率a(H2O)随时间变化的示意图,
如右图 所示,b点:υ正 υ逆(填“<”.“=”或“>”)。
所示,b点:υ正 υ逆(填“<”.“=”或“>”)。
科目:高中化学 来源: 题型:
下列微粒的个数比不是1∶1的是 ( )。
A.NaHCO3晶体中阴、阳离子
B.NH3分子中的质子和电子
C.Na2O2固体中阴、阳离子
D.12H原子中的质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
在2升的密闭容器中,发生以下反应:2A(g)+ B(g)  2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等。
B.标准状况下,1 L辛烷完全燃烧生成CO2 8 L
C.2.4 g Mg无论 与O2还是与N2完全反应,转移电子数都是0.2NA
与O2还是与N2完全反应,转移电子数都是0.2NA
D.1 L 1 mol·L-1 CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
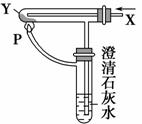
按右图装置通入X气体,并在管口P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
A.H2和Fe2O3 B.CO和CuO
C.H2和Na2CO3 D.CO和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是学习化学的一种重要方法,某实验小组的同学利用下列装置完成了一些常见气体的制备以及相关物质性质探究(夹持装置及连接用的橡胶管已省略,其中装置E有多个供使用)。

可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、碱石灰、Cu、Zn、Na2S |
请回答下列问题:
(1)装置B中a仪器的名称________。
(2)可由A装置制取相对分子质量小于32的气体有________(任意写2种)。
(3)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→________→C←________←________←B。写出装置B(无需加热)中反应的离子方程式_________________________________________________。
(4)完成上述实验需选用仪器D和E,D中选用( )、E中选用( )(填写序号)
a.无水氯化钙 b.饱和碳酸氢钠溶液
c.饱和食盐水 d.五氧化二磷
e.碱石灰 f.浓硫酸
(5)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式__________________________________________。
(6)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是( )
A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程为___________________________________________________________,
若将钠块放到石棉网上加热会生成淡黄色固体,该反应的化学方程式为:___________________________________________________________________,
该固体遇水会有无色无味的气体生成,该反应的化学方程式为:
___________________________________________________________________;
通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 ;
工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是 ,
漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:
, 。
(二)某兴趣小组为探究Na2O2滴入酚酞试液中时溶液颜色变化的原因,设计如下方案。将2药匙Na2O2加入滴有3~4滴酚酞试剂的蒸馏水(10ml)中,发现有如下现象:
①立即有大量气泡生成。
②无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,又变为无色。
③反应放出大量的热量,试管壁手触感觉很烫。
请回答:
(1)该兴趣小组同学认为酚酞试液颜色变化的为:
假设①: 。
假设②:可能是反应放出的热量,使红色消失。
假设③:可能是Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色。
(2)验证假设②,设计补充实验:取滴加酚酞的稀NaOH溶液加热,若红色消失,则证明假设②成立;若红色不消失,则假设②不成立。
(3)验证假设③,设计补充实验: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com