
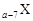 、
、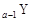 、
、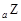 、
、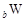 、
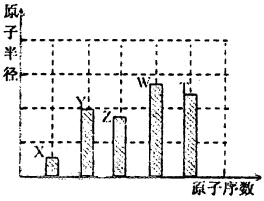
、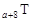 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
(1)第三周期第ⅣA族(2分)
(2)极性键(或共价键) H2O(2分)
(3)3NO2+H2O=2HNO3+NO(2分);取一小块试纸放在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测酸雨液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,记录pH(2分)
(4)OH-+SO2=HSO3-(2分);因为HSO3-存在:HSO3-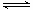 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O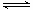 H2SO3+OH-,HSO3-的电离程度大于它的水解程度(2分)
H2SO3+OH-,HSO3-的电离程度大于它的水解程度(2分)
(5)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=—1520kJ/mol(2分)
【解析】
试题分析:Z是地壳中含量最高的元素,因此Z是氧元素。a=8,所以X、Y、T的原子序数分别是1、7、16,则分别是H、N和S元素。W原子最外层电子数是K层电子数的2倍,且W的原子半径最大,所以W是第三周期元素,因此W是Si元素。
(1)硅元素的原子序数是14,在周期表中的位置是第三周期第ⅣA族。
(2)Y、Z的10电子氢化物分子分别是NH3和H2O,其中均含有的化学键类型为极性键。非金属性越强,氢化物的稳定性越强。氧元素的非金属性强于氮元素的,因此氢化物稳定性强的是H2O。
(3)NO2溶于水生成硝酸和NO,从而形成硝酸型酸雨,反应的化学方程式为3NO2+H2O=2HNO3+NO;用pH试纸测量溶液pH值的实验操作是:取一小块试纸放在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测酸雨液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,记录pH。
(4)氢氧化钠的物质的量是1mol/L×0.1L=0.1mol,这说明与SO2的物质的量相等,因此反应中生成亚硫酸氢钠,所以反应的离子方程式为OH-+SO2=HSO3-。溶液中存在HSO3-的水解平衡和电离平衡,即HSO3-+H2O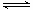 H2SO3+OH-、HSO3-
H2SO3+OH-、HSO3-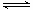 SO32-+H+,由于HSO3-的电离程度大于它的水解程度,因此溶液显酸性,即pH<7。
SO32-+H+,由于HSO3-的电离程度大于它的水解程度,因此溶液显酸性,即pH<7。
(5)W与X形成的气态化合物是SiH4,在和氧气的反应中转移8个电子(从—4价升高到+4价),所以根据题意可知,每生成1mol二氧化硅反应放出的热量=190 kJ×8=1520kJ,则该反应的热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=—1520kJ/mol。
考点:考查元素周期表的结构以及元素周期律的应用;pH试纸使用、盐类水解和电离平衡以及热化学方程式的书写等


科目:高中化学 来源: 题型:阅读理解
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 900 | 1757 | 14849 | 21007 |
| R | 2081 | 3952 | 6122 | 9370 |
| T | 496 | 4562 | 6912 | 9544 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:
A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题: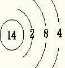

查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市三峡名校联盟高三12月联考化学试卷(解析版) 题型:填空题
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com