
(9分)有硫酸和盐酸的混合溶液,取出![]() 加入足量的
加入足量的![]() 溶液,可得白色沉淀
溶液,可得白色沉淀![]() ,另取这种混合酸液
,另取这种混合酸液![]() 与
与![]()
![]() 溶液
溶液![]() 恰好全部中和。求:
恰好全部中和。求:
(1)混合溶液中硫酸和盐酸的物质的量浓度是多少?
(2)再取![]() 这种混酸溶液,加入足量的锌粉,产生的气体在标准状况下的体积?
这种混酸溶液,加入足量的锌粉,产生的气体在标准状况下的体积?
科目:高中化学 来源: 题型:
下表中的因果关系完全正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省天水市高三模拟(5月)考试化学试卷(解析版) 题型:选择题
有关于化学实验的操作或者说法中,正确的是( )
A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低
B.配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉
C.将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷
D.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
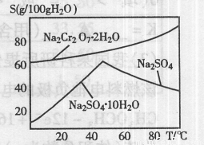
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
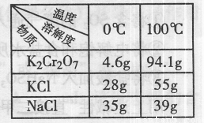
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com