
| A. | Al→AlO2- | B. | CO2→HCO3- | C. | SiO2→H2SiO3 | D. | SO2→H2SO3 |
分析 A、Al与NaOH发生反应生成AlO2-,可一步反应生成;
B、CO2与碳酸钠溶液反应生成碳酸氢钠;
C、二氧化硅和水不反应;
D、二氧化硫与水反应生成亚硫酸.
解答 解:A.Al与NaOH发生反应生成AlO2-,可一步反应生成,故A不选;
B、CO2与碳酸钠溶液反应生成碳酸氢钠,可以实现一步转化,故B不选;
C、二氧化硅和水不反应,所以不能一步生成硅酸,用二氧化硅和NaOH溶液反应生成硅酸钠,再向硅酸钠溶液中滴加稀盐酸制取硅酸,故C选;
D、二氧化硫与水反应生成亚硫酸,可以实现一步转化,故D不选;
故选C.
点评 本题考查物质之间的转化,侧重考查分析、判断能力,明确物质的性质是解本题关键,注意二氧化硫和水反应生成亚硫酸,易错选项是C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
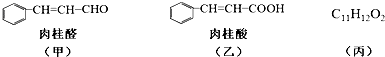
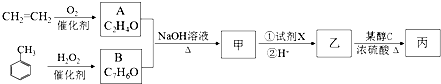
 .
. $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$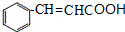 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| CO | CO2 |
| H2S | H2SO4 |
| Cl2 | HCl |
| N2O4 | NO |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-═2Cl- | |
| C. | 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+4e-═2O2- | |
| D. | 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种物质 | B. | 不同密度的核素 | ||
| C. | 同位素 | D. | 相同元素构成的不同单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨的喷泉实验:圆底烧瓶 | B. | 实验室制氧气:试管 | ||
| C. | 中和滴定:锥形瓶 | D. | 中和滴定:滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | BaCl2与Na2SO4溶液 | Ba(OH)2与H2SO4溶液 |
| B | 石灰石与硝酸反应 | 生石灰与盐酸 |
| C | 氢氧化钠与盐酸 | 氢氧化钠与硫酸氢钠 |
| D | Na2CO3溶液与硝酸溶液 | CaCO3与硝酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com