
| 39g |
| 78g/mol |
| 1.5mol |
| 4mol/L |
| 1.9mol |
| 4mol/L |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
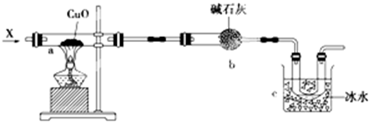
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知,CH3CH2OH+NaBr+H2SO4
已知,CH3CH2OH+NaBr+H2SO4| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅广泛存在自然界中,天然单质硅叫硅石 |
| B、晶体硅结构类似于金刚石,硬度也很大 |
| C、氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中 |
| D、烧碱液能腐蚀玻璃并生成硅酸钠,所以烧碱液要存放在带橡胶塞的玻璃瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com