
【题目】一种可用于生物医学领域的平面五角星形钯(Ⅱ)配位络离子结构如右图,已知钯是原子序数为46的过渡元素。
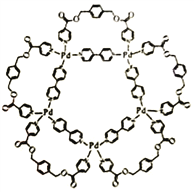
回答下列问题。
(1)钯(Ⅱ)配位络离子中的第二周期元素,其第一电离能从大到小的顺序为_____________(填元素符号)。
(2)钯(Ⅱ)配位络离子中含有的作用力类型为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(3)钯(Ⅱ)配位络离子中基态钯离子价电子排布式为____________,钯离子的杂化轨道类型_______(填“是”或“不是”)sp3,理由是___________。
(4)钯(Ⅱ)配位络离子中能与氢氧化钠溶液反应的配体,其分子式为__________,每1mol该配体与氢氧化钠反应时断裂的共价键类型及数目为____________。
(5)钯易与亚砜(![]() )生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
)生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
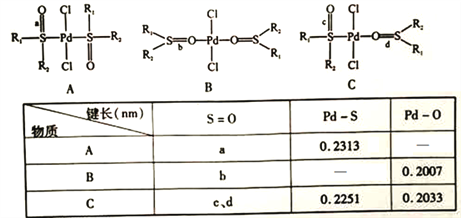
①亚砜的晶体类型为___________________。
②配位键稳定性:Pd-s>Pd-O,其证据为______________ (用上表数据说明)。
③三种配合物中S=O键长不同,其数值最小的是______________(填“a"“b"“c”或“d")
【答案】 N>O>C C、D 4d8 不是 若SP3杂化类型 ,空间构型应为四面体型,不可能形成五角星形(钯离子还有4d空轨道) C20H16N2O4 δ键或极性键 2NA 分子晶体 Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm C
【解析】(1)钯(Ⅱ)配位络离子中的第二周期元素,C、N、O处于同一周期,从左到右第一电离能有变大的趋势,N的2p能级处于半充满状态,其第一电离能变大,故第一电离能从大到小的顺序为N>O>C;(2)钯(Ⅱ)配位络离子中含有的作用力类型为 C.共价键:C-N键等 、D.配位键:Pd-N键;没有以下类型的键:A.金属键,只存在于金属原子间;B.离子键:存在于阴阳离子间; E.氢键:存在于电负性较大的原子与H原子间; F.范德华力:存在于分子间;故选CD。(3)钯(Ⅱ)配位络离子中基态钯离子价电子排布式为4d8,钯离子的杂化轨道类型不是sp3,理由是 若SP3杂化类型 ,空间构型应为四面体型,不可能形成五角星形(钯离子还有4d空轨道)。(4)钯(Ⅱ)配位络离子中能与氢氧化钠溶液反应的配体含有酯基,其分子式为C20H16N2O4,每1mol该配体与氢氧化钠反应时C-O键断裂,共价键类型为δ键或极性键,数目为 2NA ;(5)钯易与亚砜(![]() )生成配合物。①亚砜由分子构成,晶体类型为分子晶体。②配位键稳定性:Pd-s>Pd-O,其证据为Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm ,键长越短越稳定。③b中O电子提供给Pd,S=O键长最长,A、C对比,如图
)生成配合物。①亚砜由分子构成,晶体类型为分子晶体。②配位键稳定性:Pd-s>Pd-O,其证据为Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm ,键长越短越稳定。③b中O电子提供给Pd,S=O键长最长,A、C对比,如图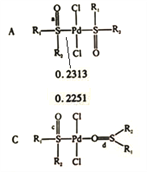 C中O吸改Pd电子,增大Pd下S之间作用,c的S=O键长最短,三种配合物中S=O键长不同,其数值最小的是c。
C中O吸改Pd电子,增大Pd下S之间作用,c的S=O键长最短,三种配合物中S=O键长不同,其数值最小的是c。


科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某 KCl 样品中含有少量 K2CO3、K2SO4 和不溶于水的杂质。为了提纯 KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是

A. 步骤④的操作是过滤
B. 试剂Ⅰ为 BaCl2 溶液
C. 上图过程须经 2 次过滤
D. 步骤③目的是除去 Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,物质X2SO4的饱和溶液密度为ρg·mL-1,c(X+)=cmol·L-1 ,溶质 的质量分数为a% ,溶质的摩尔质量为Mg·mol-1,溶解度为Sg,下列表达式正确的是( )
A. c=2000ρa/M B. a%=c/2000ρ
C. M=1000ρa%/c D. S=100cM/(2000ρ-cM)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
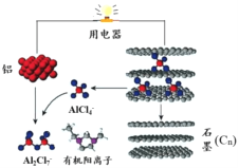
A. 放电时,铝为负极,石墨为正极
B. 放电时的负极反应为:Al-3e-+7AlCl4-===4Al2Cl7-
C. 充电时的阳极反应为:Cx+ AlCl4--e-===CxAlCl4
D. 放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用 98%的浓硫酸(ρ=1.84g/cm3 )配制 1mol/L 稀硫酸 480mL.
(1)实验中应选用的玻璃仪器除了量筒、烧杯、玻璃棒外还需要_____ (填仪器名称)
(2)实验操作:
a.用量筒量取 98%的浓硫酸;
b.将稀释后的浓硫酸转移到容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒 2~3 次,并将洗涤液转移到容量瓶中; d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌; e.向容量瓶中直接加蒸馏水至刻度线 1~2cm 处; f.盖上容量瓶瓶塞,摇匀,装瓶,贴标签;g.用胶头滴管小心加蒸馏水至刻度线;
(3)实验
①步骤 a 中应该取浓硫酸______ mL;
②正确的操作步骤是 _____(填序号).
③下列操作使所配溶液的浓度偏高的有_____ (填字母符号)
A. 使用容量瓶配制溶液时,俯视刻度线定容
B. 取用敞口放置过长时间的浓硫酸
C. 容量瓶用蒸馏水洗净后还剩有少量水
D. 量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶
E. 量取浓硫酸时俯视刻度线
II.某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃, 101KPa)下的气体摩尔体积.拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为 A、_____.
(2)实验开始时,测量实验中生成 H2 的体积除了上下移动量筒使液面与广口瓶相平,平视读取量筒内 水的体积外,还要注意_____ 。
(3)实验中准确测得 3 个数据:实验前铝硅合金的质量 m1g,实验后残留固体的质量 m2g,实验后量筒中 液面读数为 V mL,则通常状况下气体摩尔体积 Vm= _____L/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护加酶洗衣粉洗涤效果,应注意
A. 使用沸水先冲泡洗衣粉 B. 用含氯较高的自来水作水源
C. 和其他洗涤剂混合使用 D. 室温时用饮用水先溶解洗衣粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )


A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+) > c(ClO-) > c(CH3COO-)> c(OH-) > c(H+)
B. 向NaClO溶液中通少量CO2的离子方程式为:2ClO- + CO2 + H2O = 2HClO + CO32-
C. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点对应酸的总浓度大于b点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com