
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )。
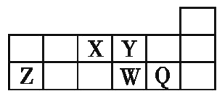
A.Y原子的电子总数是其K层电子数的3倍
B.原子半径大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)
C.Q的单质能与W的氢化物发生置换反应
D.元素W的最高价氧化物对应水化物的酸性比Q的强
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件是( )
①X中含碳质量分数 ②X中含氢质量分数 ③X在标准状况下的体积 ④质谱确定X的相对分子质量 ⑤X的质量
A. ①② B. ①②④
C. ①②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l) ![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
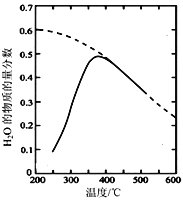
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。
② 温度过高或过低均不利于该反应的进行,原因是__________________________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中H2所占比例
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。可用电解LiCl溶液制备LiOH,装置如下图所示。下列说法正确的是
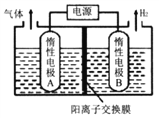
A. 电极B连接电源正极
B. A极区电解液为LiCl溶液
C. 阳极反应式为:2H2O+2e-= H2↑+2OH-
D. 每生成1molH2,有1molLi+通过该离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、C、Na、O、Ca六种元素,请选用其中的元素书写下列化学用语:
①可做食品干燥剂的氧化物__________ ;
②厨房中常用的酸__________________ ;
③侯氏制碱法制得的“碱”____________ ;
④含氧量最高的氧化物______________ 。
(2)铅蓄电池在生产、生活中使用广泛.其构造示意图如图,回答下列问题:
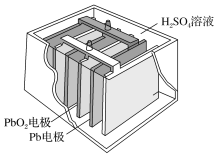
①铅蓄电池充电时是将电能转化为__________ 能。
②铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4===2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断__________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是
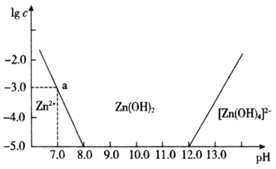
A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的结构和性质叙述中,不正确的是( )
A.苯能使酸性高锰酸钾溶液褪色
B.苯燃烧时能产生大量黑烟
C.苯难溶于水
D.常温下,苯不能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
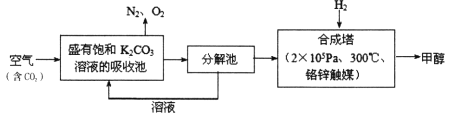
回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:____________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①____________;②________。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:
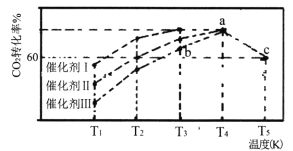
①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。c点时该反应的平衡常数K=___________。
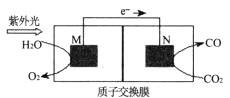
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为_________________。
(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的感光树脂,它的一种合成路线如下:
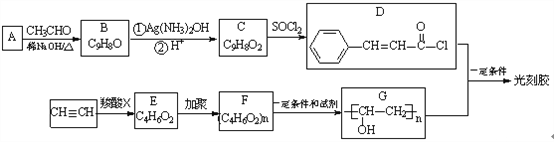
已知:
Ⅰ.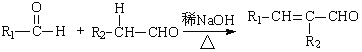 (R,R’为烃基或氢)
(R,R’为烃基或氢)
Ⅱ.![]() (R,R’为烃基)
(R,R’为烃基)
回答下列问题:
(1)A的化学名称是__________。C中所含的官能团是________________。
(2)C→D的反应类型是____________。E的结构简式为_________________。
(3)D+G→光刻胶的化学方程式为________________________。
(4)T是C的同分异构体,T具有下列性质或特征:①能发生水解反应和银镜反应;②属于芳香族化合物且分子结构中除苯环外无其它环。则T的结构有____种。其中核磁共振氢谱为5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式为______________。
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOH的合成路线流程图(无机试剂任用)。(合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com