
科目:高中化学 来源: 题型:填空题
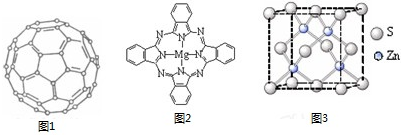
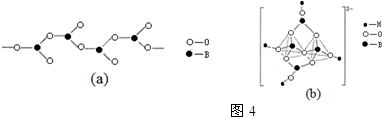
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由碳元素组成的物质一定是纯净物 | |
| B. | 金刚石和石墨由相同的元素组成,因此它们具有相同的性质 | |
| C. | 石墨转变为金刚石的反应属于氧化还原反应 | |
| D. | C60是新发现的一种碳单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测得Ca(ClO)2溶液的pH为10 | |
| C. | 用托盘天平称取20.00 g NaOH固体 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com