
【题目】(一)现有浓度均为![]() 的盐酸、硫酸、醋酸三种溶液,回答下列问题:
的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)若三种溶液中![]() 分别为
分别为![]() ,则它们的大小关系为_________________________________________。
,则它们的大小关系为_________________________________________。
(2)等体积的以上三种酸分别与过量的![]() 溶液反应,若生成的盐的物质的量依次为
溶液反应,若生成的盐的物质的量依次为![]() ,则它们的大小关系为__________________________。
,则它们的大小关系为__________________________。
(3)分别用以上三种酸中和一定量的![]() 溶液生成正盐,若需要酸的体积分别为
溶液生成正盐,若需要酸的体积分别为![]() ,其大小关系为__________________________________。
,其大小关系为__________________________________。
(4)分别与锌反应,开始时生成氢气的速率为![]() ,其大小关系为______________________。
,其大小关系为______________________。
(二)有![]() 四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 |
|
阴离子 |
|
已知:①![]() 溶液的
溶液的![]() 均大于7,
均大于7, ![]() 的溶液中水的电离程度相同;②
的溶液中水的电离程度相同;②![]() 溶液和
溶液和![]() 溶液相遇时只生成白色沉淀,
溶液相遇时只生成白色沉淀, ![]() 溶液和
溶液和![]() 溶液相遇时只生成刺激性气味的气体,
溶液相遇时只生成刺激性气味的气体, ![]() 溶液和
溶液和![]() 溶液混合时无现象。
溶液混合时无现象。
(1) ![]() 是_________________________,
是_________________________,![]() 是_______________________(填化学式)。
是_______________________(填化学式)。
(2)写出![]() 和
和![]() 反应的离子方程式_________________________________。
反应的离子方程式_________________________________。
(3) ![]() 时,
时, ![]() 溶液的
溶液的![]() ,则
,则![]() 溶液中
溶液中![]() _________________________________________(用含有
_________________________________________(用含有![]() 的关系式表示)。
的关系式表示)。
(4)将等体积、等物质的量浓度的![]() 溶液和
溶液和![]() 溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_________________________。
(5)在一定体积的![]() 的
的![]() 溶液中,加入一定体积的
溶液中,加入一定体积的![]() 的盐酸,混合溶液的
的盐酸,混合溶液的![]() ,若反应后溶液的体积等于
,若反应后溶液的体积等于![]() 溶液与盐酸的体积之和,则
溶液与盐酸的体积之和,则![]() 溶液与盐酸的体积比是_______________。
溶液与盐酸的体积比是_______________。
【答案】![]() 或者是
或者是![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 1:4
1:4
【解析】
(一)(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离。醋酸是一元弱酸,不能完全电离,据此分析;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,据此分析;
(4)生成氢气速率的大小决定于氢离子浓度的大小;
(二)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀;
(3)根据溶液中电荷守恒、物料守恒计算c(H+)-c(NH3H2O);
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,根据溶液中的溶质性质确定离子浓度关系;
(5)混合溶液的pH=11,溶液显碱性,则碱过量,结合![]() =0.001计算。
=0.001计算。
(一)(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离。醋酸是一元弱酸,不能完全电离。所以浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液中,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,所以![]() a1=a2>a3或者是
a1=a2>a3或者是![]() ;
;
(2)等体积的浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,所以其与NaOH反应生成盐的物质的量相同,故答案为:b1=b2=b3;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,分别用以上三种相同浓度的酸中和等物质的童的NaOH溶液生成正盐,需要碱液体积最少的酸为硫酸,故答案为:![]() ;
;
(4)浓度均为0.1molL-1的盐酸、硫酸、醋酸三种溶液,氢离子浓度分别为0.1molL-1、0.2molL-1、小于0.1molL-1,生成氢气速率的大小决定于氢离子浓度的大小,所以分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为v2>v1>v3;
(二)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,另一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,另一种溶液含有氢氧根离子。A溶液和
(1)通过以上分析知,A是CH3COONa、B是NH4Cl,故答案为:CH3COONa;NH4Cl;
(2)C是氢氧化钡、D是硫酸钠,钡离子和硫酸根离子反应生成硫酸钡沉淀,离子方程式为Ba2++SO42-=BaSO4↓;
(3)根据溶液中电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),根据溶液中物料守恒得 c(NH3H2O)+c(NH4+)=c(Cl-),将两个等式相减得c(H+)-c(NH3H2O)=c(OH-)=10 a-14;
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+);
(5)混合溶液的pH=11,溶液显碱性,则碱过量,过量c(OH-)=0.001mol/L,由C的体积为x,盐酸的体积为y,由![]() =0.001可知,
=0.001可知,![]() =0.001,解得x:y=1:4。
=0.001,解得x:y=1:4。


科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Ksp[Pd(OH)2]=1.0×10-30。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加Pd(NO3)2溶液产生Pd(OH)2、PdS两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。图中的p(Pd)=-lgc(Pd2+),p(B)=-lgc(OH-)或-lgc(S2-)。下列说法错误的是( )

A. 曲线Ⅰ表示的是Pd2+与OH-浓度关系的曲线
B. 该温度下,Ksp(PdS)=1.0×10 -58
C. 升高温度时,b点可能会向c点移动
D. 该温度下,向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
查看答案和解析>>
科目:高中化学 来源: 题型:
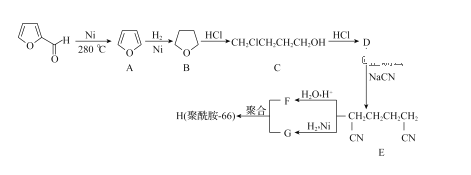
【题目】糠醛(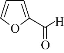 ),又称a一呋喃甲醛,是一种制备多种药物和化工产品的原料。一种由它制备锦纶-66的合成路线如图:
),又称a一呋喃甲醛,是一种制备多种药物和化工产品的原料。一种由它制备锦纶-66的合成路线如图:
已知:(1)R-CN![]() R-COOH R-CN
R-COOH R-CN![]() R-CH2NH2
R-CH2NH2
(2)RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
回答下列问题:
(1)C中含有的官能团名称为______。
(2)有机物D的化学名称为________。
(3)由D生成E的反应类型为_______。
(4)写出F和G反应生成H的化学方程式:______。
(5)糠醛催化加氢后的产物为C5H10O2,与其互为同分异构体且属于酯的有机物共有_____种。
(6)以糠醛和乙醇为原料(其他试剂任选),设计制备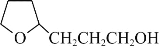 的合成路线。______
的合成路线。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与足量的氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O → 2C6H5OH+CO![]()
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- ![]() CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示。回答下列问题。

(1)图中CD段反应的化学方程式为___________;C点存在的固体物质为________。
(2)A点的数据为_______;混合液中,MgCl2的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)
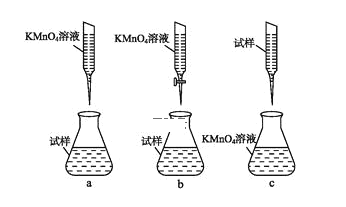
③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com