
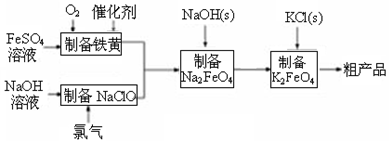
���� �Ʊ�������أ�����������+2�۵������л�ԭ�ԣ��������������ԣ����߷�Ӧ�������ƣ���ӦΪ��4Fe2++O2+6H2O=4FeOOH+8H+���������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH�TNaCl+NaClO+H2O�����ƺʹ������Ʒ�Ӧ���ɸ������ƣ�2FeOOH+3NaClO+4NaOH=2Na2FeO4+3NaCl+3H2O��������������Һ���ܽ�ȴ��ڸ�����أ������Ȼ��أ�2KOH+Na2FeO4 =K2FeO4+2NaOH��������������Һ��ת���ɸ�����أ����ã����˻�ôֲ�Ʒ���ݴ˷������
��� �⣺��1����ⱥ��ʳ��ˮ�������������Ϊ�������ƺ������������ķ�ӦΪ��NaCl+H2O$\frac{\underline{\;���\;}}{\;}$NaClO+H2����
�ʴ�Ϊ��NaCl+H2O$\frac{\underline{\;���\;}}{\;}$NaClO+H2����
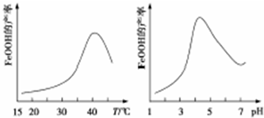
��2������������+2�۵������л�ԭ�ԣ������������ԣ����߷���������ԭ��Ӧ�������ƣ���ӦΪ��4Fe2++O2+6H2O=4FeOOH+8H+������ͼ��40������ʱ�����Ʋ��ʽϸߣ�PH����4.5ʱ�����Լ�������������������ʹ�����Ʋ��ʽ��ͣ�
�ʴ�Ϊ��4Fe2++O2+6H2O=4FeOOH+8H+��40�棻���Լ�����Fe��OH��3���ࣻ
��3��������ؾ��������ԣ����Խ�CN-����Ϊ�����Ͷ�����̼����ȥ����������ԭΪ�����������ڼ�����Һ�ж�����̼���̼������ӣ���Ӧ�ķ���ʽΪ��10FeO42-+6CN-+22H2O=10Fe��OH��3�����壩+6CO32-+3N2��+14OH-��
�ʴ�Ϊ��10FeO42-+6CN-+22H2O=10Fe��OH��3�����壩+6CO32-+3N2��+14OH-��
��4��PH=2ʱ��C��OH-��=10-12mol/L������Ksp[Fe��OH��3]=4.0��10-38��C��Fe3+��=$\frac{4.0��1{0}^{-38}}{��1{0}^{-12}��^{3}}$mol/L=0.04mol/L��
�ʴ�Ϊ��0.04��
��5��1mol 2mol•L-1FeSO4��Һ�к���2molFeSO4��������Ԫ���غ㣬���ɸ�����ص�����Ϊ��m=2mol��75%��198g/mol��90%=330g��
�ʴ�Ϊ��330��
���� ���⿼�������ʵ��Ʊ����漰�Թ������̵����⡢������ԭ��Ӧ���������Ŀ���ѡ�������⡢�ܶȻ��ļ���ȣ����������ԭ���ǽ���Ĺؼ����Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ��������������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
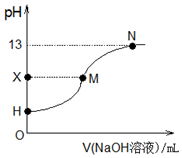
| A�� | ���ζ�ѡ��ָʾ����������Һ | |
| B�� | H�㴦����Һ��pH��3 | |
| C�� | X=7ʱ��M���Ӧ��������������Һ�������25.00 mL | |
| D�� | H��M��N������Զ�Ӧ����Һ��c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ͭ��Ӧ�õ�NO2��N2O4��23g����ͭʧȥ�ĵ�����Ϊ0.5NA | |
| B�� | 10g 46%���Ҵ�ˮ��Һ��������ԭ����ĿΪ0.6NA | |
| C�� | ��״����8.96L��ƽ����Է�������Ϊ3.5��H2��D2����������0.3NA | |
| D�� | 1molCu��������S��ȫ��Ӧ��ת�Ƶ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ��Ӧ | B�� | �����ڿ�����ȼ�� | ||
| C�� | ����������������Һ��Ӧ | D�� | ̼�������̼���·�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
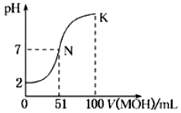
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
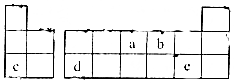
| A�� | ��̬�⻯����ȶ��ԣ�a��b��c | |
| B�� | ԭ�Ӱ뾶��С��a��b��c | |
| C�� | c��d��e���������Ӧ��ˮ����֮���������ܷ�Ӧ | |
| D�� | b��c�γɵĻ����������������ӵĸ�����Ϊ1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
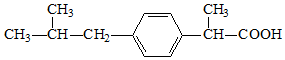
| A�� | ����ҵķ���ʽΪC13H18O2 | |
| B�� | ������뱽������ͬϵ�� | |
| C�� | 1mol ������������3mol ���������ӳɷ�Ӧ | |
| D�� | ������ڱ����Ϸ���ȡ����Ӧ����һ�ȴ�����4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
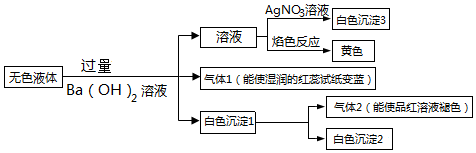
| A�� | ����2һ����SO2 | B�� | ��ɫ����2һ����BaSO4 | ||
| C�� | ��ɫ����1�ijɷ�ֻ��2�ֿ��� | D�� | ��Һ��ֻ��HCO3-��ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com