
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
分析 A.苯酚钠溶液中通入少量CO2生成苯酚和碳酸氢钠;
B.过氧化氢具有强氧化性,可氧化亚铁离子生成铁离子;
C.用氨水吸收少量的SO2生成亚硫酸铵;
D.碳酸氢钠溶液中加入过量石灰水生成碳酸钙沉淀.
解答 解:A.苯酚钠溶液中通入少量CO2生成苯酚和碳酸氢钠,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A错误;
B.过氧化氢具有强氧化性,可氧化亚铁离子生成铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故B正确;
C.用氨水吸收少量的SO2生成亚硫酸铵,反应的离子方程式为2NH3•H2O+SO2═2NH4++SO32-+H2O,故C错误;
D.碳酸氢钠溶液中加入过量石灰水生成碳酸钙沉淀,反应的离子方程式为HCO3-+OH-+Ca2+=CaCO3↓+H2O,故D错误.
故选B.
点评 本题离子方程式的书写,为高频考点,明确发生的反应是解答本题的关键,注意与量有关的离子反应即可解答,题目难度中等,本题考查离子反应的知识较全.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的硫酸铝溶液中含有的Al3+为2NA | |
| B. | pH=1的H2SO4溶液中含有H+的数目为0.2NA | |
| C. | 常温下5.6 g Fe与足量的浓硝酸反应,转移电子的数目为0.3NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
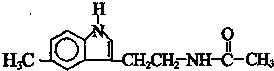 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
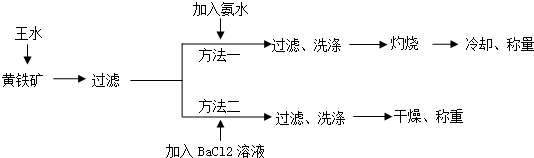
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com