
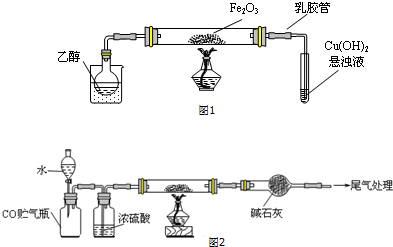
分析 (1)气体发生的反应是需要装置气密性检验,新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀;
(2)乙醇易挥发,依据图1装置分析可知,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管;
(3)乙醇在催化剂作用下氧化为乙醛,乙醛通入氢氧化铁溶液中加热反应生成红色沉淀为氧化亚铜、乙酸和水;
(4)依据铁离子的实验检验方法分析,亚铁离子具有还原性,加入氧化剂会发生氧化还原反应;乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引;
(5)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
(6)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值.
解答 解:(1)依据装置图分析可知反应过程需要在气密性好的装置中进行,定量测定,所以气体通过装置,实验前需要检验装置气密性,新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀,制备过程为在过量NaOH溶液中滴加数滴CuSO4溶液,
故答案为:检验装置气密性;在过量NaOH溶液中滴加数滴CuSO4溶液;
(2)依据图1装置分析可知,乙醇易挥发,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管,
故答案为:在烧杯中加入热水(对烧杯加热);c;
(3)乙醇在催化剂作用下氧化为乙醛,乙醛通入氢氧化铁溶液中加热反应生成红色沉淀为氧化亚铜、乙酸和水,反应的化学方程式为:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ Cu2O↓+CH3COOH+2H2O,
故答案为:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ Cu2O↓+CH3COOH+2H2O;
(4)依据铁离子的实验检验方法分析,亚铁离子加入紫红色的酸性高锰酸钾溶液,两者发生氧化还原反应溶液褪色,则有Fe2+;氧化铁做催化剂参与反应过程,乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引;
故答案为:取少量溶液于试管中,加入酸性高锰酸钾溶液,若紫红色褪去,则说明有Fe2+;d;
(5)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c,
故答案为:c;
(6)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,则n(Fe):n(O)=$\frac{a-b}{56}$:$\frac{b}{16}$=$\frac{2(a-b)}{7b}$,
故答案为:$\frac{2(a-b)}{7b}$.
点评 本题考查了氧化铁与乙醇的反应的性质的实验探究和产物组成的分析判断,掌握二价铁离子的性质,注意实验过程中的反应实质分析判断,现象的理解和应用是解题关键,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 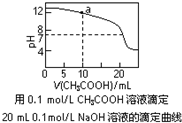 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | B. | c(HAc)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
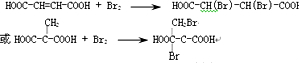
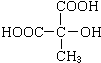 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com