
【题目】化学在能源开发与利用中起着十分关键的作用。能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。甲烷、氢气是重要的能源。回答下列问题:
(1)关于甲烷、氢气的说法正确的是___
A.甲烷和氢气都是一级能源 B.甲烷是一级能源,氢气是二级能源
C.甲烷和氢气都是二级能源 D.甲烷是二级能源,氢气是一级能源
(2)![]() 经催化重整可以获得合成气:
经催化重整可以获得合成气:![]()
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H |
| H—H |
|
键能/ | 413 | 745 | 436 | 1075 |
则该反应的![]() _____
_____![]() 。
。
②已知:![]()
![]()
![]()
![]()
而C(s)的燃烧热![]()
该催化重整反应的![]() ___
___![]() (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(3)氢气是氯碱工业的副产品,产生氢气的电极反应式为___。
(4)利用氢气可以合成氨,将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() 写出
写出![]() 的电子式__。该反应的化学方程式为____。
的电子式__。该反应的化学方程式为____。
(5)CO也是一种重要燃料,利用其燃烧可以设计成新型燃料电池,该电池利用熔融的碳酸盐为电解质,该燃料电池负极的电极反应式为____。
【答案】B ![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。据此判断;
(2)①根据△H=反应物的键能之和-生成物的键能之和计算;
②根据盖斯定律计算;
(3)由于氢气在阴极产生,氢离子得电子生成氢气;
(4)N2H4分子中N-N以单键结合,每个氮与两个氢形成一个共价键外,还有一个孤电子对;将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() ,NaCl和H2O;
,NaCl和H2O;
(5)燃料电池负极CO失电子与CO32-结合生成CO2。
(1)由题目叙述可知,甲烷为自然界中存在的化石燃料,所以为一级能源,而氢气需要其它途径获得,所以为二级能源,答案选B。
(2)①根据键能数据,![]()
![]() ;
;
②已知:ⅰ ![]()
![]()
ⅱ ![]()
![]()
根据C(s)的燃烧热可知ⅲ C(s)+O2(g)=CO2(g)![]()
根据盖斯定律2×ⅱ-ⅰ-ⅲ即可得到![]()
![]() 。
。
(3)由于氢气在阴极产生,电极反应为![]() 。
。
(4)![]() 的电子式为
的电子式为![]() ,将
,将![]() 通入NaClO的溶中可以获得
通入NaClO的溶中可以获得![]() ,NaCl和H2O,离子方程式为
,NaCl和H2O,离子方程式为![]() 。
。
(5)负极反应物为CO,碳酸根离子传递电荷,负极反应式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 常温常压下,8gO2和O3的混合气体含有4NA个电子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA个Fe(OH)3胶体粒子
C. 标准状况下,22.4LCl2通入水中发生反应,转移的电子数为NA
D. 1molNa被完全氧化生成Na2O2,失去个2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,ag该晶体能够溶于bg水中形成V mL饱和溶液。下列关系中不正确的是( )
A.该溶液的密度为ρ=![]() g·L-1
g·L-1
B.该溶液的物质的量浓度为c=![]() mol·L-1
mol·L-1
C.该溶液中溶质的质量分数为w=![]() %
%
D.25℃时R的溶解度S=![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有![]() 个氩原子的氩气在标准状况下的体积约为22.4L
个氩原子的氩气在标准状况下的体积约为22.4L
B.标准状况下,11.2L![]() 含有的分子数为0.5
含有的分子数为0.5![]()
C.在常温常压下,11.2 L ![]() 含有的分子数为0.5
含有的分子数为0.5![]()
D.常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为______________;
②Ⅱ中铜丝上观察到的现象是_____________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为________。
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是__,被氧化的元素是____,氧化剂是____,还原剂是__,氧化产物是____,还原产物是_____。
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中氧化产物是_____;若反应中转移了0.3 mol电子,则还原产物的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是____;氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是____。
(2)若采用下图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①____;该装置还缺少的仪器是__;冷凝管的进水口是:__(填g或f)。
Ⅱ.我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)配制上述溶液除250mL容量瓶、烧杯、胶头滴管、量筒外还需要的玻璃仪器是___。
(2)根据计算,需要36.5%的浓盐酸的体积为______mL。
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)_______。
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)假设配制时其他操作均正确,只出现以下哪种情况时,会造成所配制的溶液浓度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸馏水
B.定容时仰视容量瓶读数
C.定容时俯视容量瓶读数
D.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定 0.1 mol/LNa2SO3溶液先升温再降温过程中的 pH ,数据如下。

实验过程中,取①、④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
A. 此实验中 Na2SO3溶液的 pH 是由 pH 计测定的
B. ④与①的 PH 不同,是由于 SO32—浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的 KW值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上通常把原子数和电子数相等的分子或离子称为等电子体,研究发现等电子体间结构和性质相似(等电子原理).化合物B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
A. 无机苯是仅由极性键组成的分子
B. 无机苯能发生取代反应
C. 无机苯的二氯代物有3种同分异构体
D. 无机苯不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
其中铜、硒、碲的主要回收流程如图:
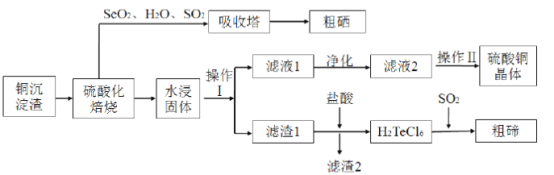
(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com