
| A.NO:0.001mol?L-1 | B.H2O:0.002mol?L-1 |
| C.NH3:0.002mol?L-1 | D.O2:0.0025mol?L-1 |
| △c |
| △t |
| ||
| △t |
| ||
| 60s |
| 6 |
| 4 |
| 5 |
| 4 |


科目:高中化学 来源:不详 题型:单选题
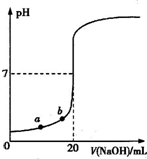
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100mol?L-1?? |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.υ(D)=0.4mol?L-1?s-1 | B.υ(C)=0.5mol?L-1?s-1 |
| C.υ(B)=0.6mol?L-1?s-1 | D.υ(A)=2mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.v(NH3)=0.010mol/(L?s) | B.v(O2)=0.10mo1/(L?s) |
| C.v(NO)=0.10mo1/(L?s) | D.v(H2O)=0.45mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.v(NH3)=0.02mol?L-1?s-1 |
| B.v(O2)=0.01mol?L-1?s-1 |
| C.v(N2)=0.02mol?L-1?s-1 |
| D.v(H2O)=0.02mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 K(g)+NaCl(l)
K(g)+NaCl(l) | A.②⑥ | B.①②③ | C.②⑤⑥ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2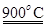 mCeO2+xH2+xCO
mCeO2+xH2+xCO L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com